Méthylvinylcétone
| Méthylvinylcétone | |

| |
| Structure de la méthylvinylcétone | |
| Identification | |
|---|---|
| Nom UICPA | but-3-én-2-one |
| Synonymes |
3-butén-2-one, buténone |
| No CAS | |
| No ECHA | 100.001.055 |
| No CE | 201-160-6 |
| No RTECS | EM9800000 |
| ChEBI | 48058 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore très inflammable à l'odeur désagréable[1] |
| Propriétés chimiques | |
| Formule | C4H6O [Isomères] |
| Masse molaire[2] | 70,089 8 ± 0,003 9 g/mol C 68,54 %, H 8,63 %, O 22,83 %, |
| Propriétés physiques | |
| T° ébullition | 81 °C[1] |
| Solubilité | miscible avec l'eau |
| Masse volumique | 0,83 g·cm-3[1] à 20 °C |
| T° d'auto-inflammation | 491 °C[1] |
| Point d’éclair | −7 °C[1] |
| Limites d’explosivité dans l’air | entre 2,1 % et 15,6 % en volume[1] |
| Pression de vapeur saturante | 100 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
| H225, H314, H317, H410, H300+H310+H330, P210, P280, P301+P310+P330, P303+P361+P353, P304+P340+P310 et P305+P351+P338+P310 |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 23,1 mg·kg-1 (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La méthylvinylcétone est un composé organique de formule CH3C(O)CH=CH2. C'est la plus simple des énones. Elle se présente sous la forme d'un liquide incolore très inflammable, susceptible de former des mélanges explosifs avec l'air, à l'odeur piquante désagréable. Elle est soluble dans l'eau et les solvants polaires. Sa manipulation est particulièrement dangereuse car elle est toxique et corrosive, et a tendance à former des peroxydes explosifs et à polymériser sous l'effet de la lumière. C'est un intermédiaire utile à la synthèse d'autres composés[4].
Elle est produite industriellement par condensation d'acétone CH3C(O)CH3 et de formaldéhyde HCHO suivie par une déshydratation. Elle est également préparée par la réaction de Mannich à partir de chlorure de diéthylammonium [(CH3CH2)2NH2]Cl, ce qui donne l'adduit de Mannich[4],[5], à partir duquel la méthylvinylcétone est obtenue par chauffage avec libération de chlorure de diéthylammonium[5] :
- CH3C(O)CH3 + HCHO + [(CH3CH2)2NH2]Cl ⟶ [CH3C(O)CH2CH2N(H)(CH2CH3)2]Cl + H2O ;
- [CH3C(O)CH2CH2N(H)(CH2CH3)2]Cl ⟶ CH3C(O)CH=CH2 + [(CH3CH2)2NH2]Cl.
Réactions et applications
[modifier | modifier le code]La méthylvinylcétone peut agir comme agent alkylant car c'est un accepteur de Michael efficace. Elle a été étudiée initialement pour son utilisation dans l'annélation de Robinson, méthode utile pour la préparation de stéroïdes :
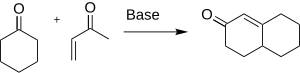
.
Ses propriétés alkylantes rendent ce composé à la fois très toxique et utile comme intermédiaire en synthèse organique. La méthylvinylcétone tend à polymériser spontanément et est stockée dans l'hydroquinone afin d'inhiber la polymérisation.
En tant qu'alcène électrophile, elle forme un adduit avec le cyclopentadiène. Le dérivé de norbornène obtenu est un intermédiaire dans la synthèse du bipéridène, un anticholinergique. Son groupe cyanhydrine en fait également un précurseur de la vinclozoline, un fongicide. Elle est également un précurseur de la vitamine A synthétique[4].
Notes et références
[modifier | modifier le code]- Entrée « Methyl vinyl ketone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 mars 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Methyl vinyl ketone, tech. 90%, stab. », sur Alfa Aesar (consulté le ).
- (en) Hardo Siegel et Manfred Eggersdorfer, « Ketones », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a15_077, lire en ligne)
- (en) Alfred L. Wilds, Robert M. Nowak et Kirtland E. McCaleb, « 1-Diethylamino-3-butanone », Organic Syntheses, vol. 37, , p. 18 (DOI 10.15227/orgsyn.037.0018, lire en ligne)







