Oxychlorure de bismuth
| Oxychlorure de bismuth | |
| |
| Identification | |
|---|---|
| Synonymes |
Chlorure de bismuthyle |
| No CAS | |
| No ECHA | 100.029.202 |
| No CE | 232-122-7 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | Cristaux blancs brillants avec une réflexion de la lumière irisée nacrée |
| Propriétés chimiques | |
| Formule | BiOCl |
| Masse molaire[1] | 260,433 ± 0,002 g/mol Bi 80,24 %, Cl 13,61 %, O 6,14 %, |
| Propriétés physiques | |
| Solubilité | négligeable soluble dans les acides |
| Masse volumique |
|
| Cristallographie | |
| Système cristallin | Tétragonal |
| Symbole de Pearson | [3] |
| Classe cristalline ou groupe d’espace | P4/nmm, No. 129 |
| Paramètres de maille | a = 0,3887 nm c = 0,7354 nm |
| Précautions | |
| SGH | |
| H315, H319, H335, P261, P264, P271, P280, P312, P321, P362, P302+P352, P304+P340, P305+P351+P338, P332+P313, P337+P313, P405, P403+P233 et P501 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxychlorure de bismuth est un composé inorganique du bismuth de formule BiOCl. Il est obtenu par extraction depuis le minéral bismoclite (en) ou par synthèse. Présent sous forme d'une poudre blanche, celui-ci est principalement utilisé dans les cosmétiques pour son aspect brillant perlé et sa bonne adhérence sur la peau[4]. Des usages sont aussi en cours de recherche en Chine pour son rôle dans la dépollution de l'eau[5].
Structure
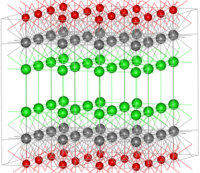
[modifier | modifier le code]La structure de l'oxychlorure de bismuth peut être considérée comme constituée de couches d'ions Cl-, Bi(3+) et O(2-) (dans l'image : Bi = gris, O = rouge, Cl = vert). Ces ions sont ordonnés comme Cl–Bi–O–Bi–Cl–Cl–Bi–O–Bi–Cl, c'est-à-dire avec une alternance d'anions Cl-, O(2-)) et de cations Bi(3+)). La structure en couches donne lieu aux propriétés nacrées de ce matériau.
Concernant l'environnement de coordination des ions individuels, les centres bismuth adoptent une géométrie de coordination antiprisme carré déformée. Un atome Bi est coordonné à quatre atomes Cl, formant l'une des faces carrées, chacun à une distance de 3,06 Å de Bi, et à quatre atomes O formant l'autre face carrée, chacun à une distance de 2,32 Å de Bi. Les atomes O sont coordonnés de façon tétraédrique à quatre atomes Bi[3].
Synthèse et réactions
[modifier | modifier le code]BiOCl se forme lors de la réaction du chlorure de bismuth avec l'eau, c'est-à-dire l'hydrolyse :
- BiCl3 + H2O → BiOCl + 2 HCl
Lorsqu'il est chauffé au-dessus de 600°C, BiOCl se convertit en Bi24O31Cl10, appelé le "composé de Arppe" qui a une structure en couches complexe[6],[7].
Utilisation comme agent dépolluant
[modifier | modifier le code]L'oxychlorure de bismuth est un photocatalyseur qui dégrade la matière organique lorsqu'exposé aux ultraviolets sous la forme d'une réaction d'oxydoréduction. Des recherches sont en cours pour déterminer sa capacité à dépolluer les eaux usées en attaquant certains micropolluants organiques (hydrocarbures, substances médicamenteuses, pesticides...) qui n'arrivent pas à être éliminés correctement à l'heure actuelle par les stations d'épuration[8]. Cela permettrait de réduire la pollution des cours d'eau où ces molécules s'accumulent et se retrouvent dans le cycle de l'eau et dans la chaîne trophique. Dans un rôle de dépollution, l'oxychlorure de bismuth présente certains avantages clés tant économiques qu'écologiques :
- La molécule n'est pas soluble dans l'eau. Elle peut donc être filtrée lors d'un cycle d'épuration sans finir dans l'environnement.
- La molécule possède une structure très résistante aux fortes températures et aux pH acides. Cela lui permet d'être conservée dans le temps et d'être réutilisée de nombreuses fois.
- La molécule est activée lorsqu'elle est exposée à des rayons UV. Ces rayons UV sont présents naturellement dans la lumière naturelle. L'usage de l'énergie solaire présente alors un intérêt quant à la quantité d'énergie nécessaire lors du cycle de traitement.
Des recherches supplémentaires doivent être réalisées pour démontrer l'efficacité technologique de la molécule (spectre d'action/efficacité de dégradation) ainsi que sur la viabilité économique de la technologie.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Handbook of Mineralogy, vol. III (Halides, Hydroxides, Oxides), Chantilly, VA, US, Mineralogical Society of America (ISBN 0-9622097-2-4, lire en ligne), « Bismoclite »
- (en) K. G. Keramidas, G. P. Voutsas et P. I. Rentzeperis, « The crystal structure of BiOCl », Zeitschrift für Kristallographie, vol. 205, no Part 1, , p. 35–40 (ISSN 0044-2968, DOI 10.1524/zkri.1993.205.Part-1.35, Bibcode 1993ZK....205...35K)
- « Bismuth Oxychloride en cosmétique. C'est quoi? | Lesielle », sur www.lesielle.com (consulté le )
- (en) Ling Yao, Hui Yang, Zhongstang Chen, Muqing Qiu et Baowei Hu, « Bismuth oxychloride-based materials for the removal of organic pollutants in wastewater », Chemosphere, vol. N°273, (lire en ligne)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann (en), , 2e éd. (ISBN 0080379419), p. 572
- (en) U. Eggenweiler, E. Keller et V. Krämer, « Redetermination of the crystal structures of the 'Arppe compound' Bi24O31Cl10 and the isomorphous Bi24O31Br10 », Acta Crystallographica Section B, vol. 56, no 3, , p. 431–437 (ISSN 0108-7681, PMID 10877351, DOI 10.1107/S0108768100000550)
- (en) Jahan Zeb Hassan, Ali Raza, Gao Li et Yifei Zang, « Bismuth oxides for the treatment of environmental pollutants », IOP Publishing,

