Oxygène solide
L'oxygène solide désigne le dioxygène O2 refroidi en dessous de son point de congélation, soit 54,36 K (−218,79 °C) à pression atmosphérique. Comme l'oxygène liquide, il est d'apparence claire avec une légère teinte bleutée due à l'absorption de la lumière rouge (et non à la diffusion Rayleigh donnant la couleur bleue de l'atmosphère). Les molécules de dioxygène O2 sont particulièrement étudiées car elles comptent parmi les rares molécules dotées d'un moment magnétique et qu'elles en sont la plus simple représentation, étant diatomiques. Il en résulte que la structure cristalline de l'oxygène solide serait déterminée par le spin des molécules de dioxygène[1] à travers leur moment magnétique[2].
À très haute pression, supérieure à 96 GPa soit vers un million de bars, l'oxygène solide cesse d'être isolant pour devenir métallique[3] et devient même supraconducteur aux très basses températures[4].
Transitions de phase
[modifier | modifier le code]
La structure de l'oxygène solide est étudiée depuis les années 1920 et six phases cristallines sont à présent décrites de façon certaine[1],[5] :
- phase α bleu clair à pression atmosphérique et à moins de −249,35 °C à cristaux monocliniques ;
- phase β bleu pâle, à pression atmosphérique et moins de −229,35 °C à cristaux rhomboédriques (débute la conversion en tétraoxygène O4) à pression atmosphérique et température élevée) ;
- phase γ rose à pression atmosphérique et moins de −218,79 °C à cristaux cubiques ;
- phase δ orange à température ambiante sous une pression d'environ 9 GPa ;
- phase ε rouge à noire, à température ambiante et pression supérieure à 10 GPa ;
- phase ζ métallique sous une pression supérieure à 96 GPa.
L'oxygène commence par se solidifier à pression atmosphérique sous une phase dite « β » à cristaux rhomboédriques, puis, en augmentant la pression, connaît une transition en phase δ orange à 9 GPa et en phase ε rouge à 10 GPa ; la couleur rouge s'assombrit au fur et à mesure qu'on augmente la pression, jusqu'à devenir noire. En poursuivant la compression de la phase ε, une transition s'opère vers 96 GPa vers la phase ζ métallique[5].
Structure de l'oxygène rouge
[modifier | modifier le code]La transition de phase à 10 GPa s'accompagne d'une nette diminution de volume[6] et d'un changement de couleur de l'orange bleuté[Quoi ?] au rouge profond[7]. Cette phase ε a été découverte en 1979 mais sa structure est demeurée obscure. À partir de son spectre d'absorption infrarouge, on a émis l'hypothèse en 1999 qu'il pouvait s'agir de molécules de tétraoxygène O4 disposées dans un réseau cristallin[8]. Il est apparu néanmoins en 2006 par diffractométrie de rayons X que cette phase ε est en fait constituée de molécules d'octaoxygène O8[9],[10]. Cette structure n'avait pas été prédite[5], s'agissant d'un groupe O8 rhomboédrique[11] de quatre molécules de dioxygène O2 :
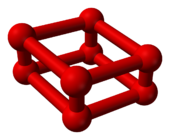
|

|
| Modèle d'une molécule O8 comme complexe (O2)4. |
Arrangement cristallin de la phase ε (oxygène rouge). |
Les dimensions des complexes O8 à 11 GPa sont de[5] :
- 120 pm pour les liaisons O=O des molécules de dioxygène O2 ;
- 234 pm pour les liaisons O2–O2 dans les tétramères (O2)4 ;
- 266 pm entre tétramères (O2)4.
L'oxygène rouge est une phase assez inhabituelle, en ce qu'elle a une couleur rouge très prononcée, une très forte absorption infrarouge et que ses propriétés magnétiques changent radicalement[1]. Les études par diffractométrie de rayons X et spectrométrie ont révélé une symétrie monoclinique C2/m, tandis que sa forte absorption dans l'infrarouge a été attribuée à l'association des molécules de dioxygène O2 dans de grands complexes.
Oxygène métallique
[modifier | modifier le code]La phase ζ d'oxygène métallique apparaît au-delà de 96 GPa par compression de la phase ε d'oxygène rouge[6]. Elle a été découverte en 1990 sous une pression de 132 GPa[3]. Elle présente un éclat métallique[12] et devient supraconductrice à basse température[4],[5].
Notes et références
[modifier | modifier le code]- (en) Freiman, Y. A. & Jodl, H. J., « Solid oxygen », Phys. Rep., vol. 401, , p. 1–228 (DOI 10.1016/j.physrep.2004.06.002)
- (en) Goncharenko, I. N., Makarova, O. L. & Ulivi, L., « Direct determination of the magnetic structure of the delta phase of oxygen », Phys. Rev. Lett., vol. 93, , p. 055502 (DOI 10.1103/PhysRevLett.93.055502)
- (en) Desgreniers, S., Vohra, Y. K. & Ruoff, A. L., « Optical response of very high density solid oxygen to 132 GPa », J. Phys. Chem., vol. 94, , p. 1117–1122 (DOI 10.1021/j100366a020)
- (en) Shimizu, K., Suhara, K., Ikumo, M., Eremets, M. I. & Amaya, K., « Superconductivity in oxygen », Nature, vol. 393, , p. 767–769 (DOI 10.1038/31656)
- (en) « Solid Oxygen ε-Phase Crystal Structure Determined Along With The Discovery of a Red Oxygen O8 Cluster » (consulté le )
- (en) Yuichi Akahama, « New High-Pressure Structural Transition of Oxygen at 96 GPa Associated with Metallization in a Molecular Solid », Physical Review Letters, vol. 74, no 23, , p. 4690–4694 (DOI 10.1103/PhysRevLett.74.4690, lire en ligne)
- (en) Malcolm Nicol, « Oxygen Phase Equilibria near 298 K », Chemical Physics Letters, vol. 68, no 1, , p. 49–52 (DOI 10.1016/0009-2614(79)80066-4)
- (en) Federico A. Gorelli, « The ε Phase of Solid Oxygen: Evidence of an O4 Molecule Lattice », Physical Review Letters, vol. 83, no 20, , p. 4093–4096 (DOI 10.1103/PhysRevLett.83.4093, lire en ligne)
- (en) Hiroshi Fujihisa, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya et Kazumasa Honda, « O8 Cluster Structure of the Epsilon Phase of Solid Oxygen », Phys. Rev. Lett., vol. 97, , p. 085503 (DOI 10.1103/PhysRevLett.97.085503, lire en ligne, consulté le )
- (en) Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers et Paul Loubeyre, « Observation of an O8 molecular lattice in the phase of solid oxygen », Nature, vol. 443, , p. 201–204 (DOI 10.1038/nature05174, lire en ligne, consulté le )
- (en) Steudel, Ralf, « Dark-Red O8 Molecules in Solid Oxygen: Rhomboid Clusters, Not S8-Like Rings », Angewandte Chemie International Edition, 2007-01-23, vol. 46, no 11, , p. 1768–1771 (DOI 10.1002/anie.200604410, lire en ligne, consulté le )
- (en) Peter P. Edwards, Friedrich Hensel, « Metallic Oxygen », ChemPhysChem, Weinheim, Germany, Wiley-VCH-Verlag, vol. 3, no 1, , p. 53–56 (DOI 10.1002/1439-7641(20020118)3:1<53::AID-CPHC53>3.0.CO;2-2, lire en ligne, consulté le )