S-Nitrosoglutathion
| S-Nitrosoglutathion | |
| |
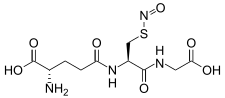
| Structure du S-nitrosoglutathion | |
| Identification | |
|---|---|
| Nom UICPA | L-γ-glutamyl-S-nitroso-L-cystéinylglycine |
| Synonymes |
GSNO |
| No CAS | |
| No ECHA | 100.165.055 |
| No RTECS | MC0558000 |
| PubChem | 104858 |
| ChEBI | 50091 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H16N4O7S [Isomères] |
| Masse molaire[1] | 336,322 ± 0,017 g/mol C 35,71 %, H 4,8 %, N 16,66 %, O 33,3 %, S 9,53 %, |
| Précautions | |
| SGH[2] | |
| H315, H319, H335, P261 et P305+P351+P338 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le S-nitrosoglutathion (GSNO) est un S-nitrosothiol endogène qui constitue une source de monoxyde d'azote NO biodisponible et joue un rôle critique dans la signalisation cellulaire faisant intervenir le monoxyde d'azote. NO coexiste dans les cellules avec les S-nitrosothiols, qui servent de donneurs et de transporteurs de monoxyde d'azote endogène. Les S-nitrosothiols libèrent spontanément du monoxyde d'azote à des vitesses différentes, et ils peuvent jouer le rôle de terminateurs efficaces des réactions par propagation en chaîne de radicaux libres en réagissant directement avec les radicaux ROO•, ce qui donne des composés nitro[3]. Le monoxyde de carbone est produit dans les cellules par les enzymes de la famille de l'oxyde nitrique synthase (NOS), tandis que les sources in vivo de nombreux S-nitrosothiols ne sont pas connues. En revanche, dans les environnements oxygénés, la formation des S-nitrosothiols résulte de l'oxydation du monoxyde d'azote en trioxyde d'azote N2O3[4]. Certains éléments suggèrent que le monoxyde d'azote exogène et le monoxyde d'azote produit de manière endogène par l'oxyde nitrique synthase peuvent l'un et l'autre réagir avec le glutathion pour donner du S-nitrosoglutathion.
La formaldéhyde déshydrogénase, également appelée S-nitrosothiol réductase (GSNOR), catalyse la réduction du S-nitrosoglutathion en un intermédiaire réactionnel instable, le S-hydroxylaminoglutathion, qui se réarrange spontanément en un sulfamidé ou, en présence de glutathion GSH, forme du glutathion oxydé GSSG et de l'hydroxylamine NH2OH[5],[6],[7]. La formaldéhyde déshydrogénase joue ainsi un rôle déterminant dans la régulation de la concentration cellulaire en S-nitrosoglutathion, ce qui a pour effet de réguler également les niveaux de S-nitrosothiols endogènes et donc la signalisation cellulaire fondée sur la S-nitrosylation des protéines.
La production de S-nitrosoglutathion peut servir de réservoir stable et mobile de monoxyde d'azote, qui peut efficacement assurer la transduction de signal[8],[9]. Contrairement à d'autres messagers de petite taille, qui activent des récepteurs cellulaires en se liant à eux, la signalisation par monoxyde d'azote est transmise par des complexes entre NO et des métaux de transition ou des protéines des cellules cibles, souvent par S-nitrosylation de résidus de cystéine[10],[11]. Diverses études suggèrent que le métabolisme du monoxyde d'azote joue un rôle important dans les maladies cardiovasculaires et respiratoires humaines, ainsi que dans la tolérance immunitaire lors des greffes d'organes[12],[13],[14],[15].
Notes et références
[modifier | modifier le code]- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Fiche Sigma-Aldrich du composé S-Nitrosoglutathione ≥97%, consultée le 28 octobre 2016.
- ↑ (en) Claudia P. M. S. de Oliveira, Vicência M. R. de Lima, Fernanda I. Simplicio, Francisco G. Soriano, Evandro S. de Mello, Heraldo P. de Souza, Venâncio A. F. Alves, Francisco R. M. Laurindo, Flair J. Carrilho et Marcelo G. de Oliveira, « Prevention and Reversion of Nonalcoholic Steatohepatitis in OB/OB Mice by S-Nitroso-N-Acetylcysteine Treatment », Journal of the American College of Nutrition, vol. 27, no 2, , p. 299-305 (PMID 18689562, DOI 10.1080/07315724.2008.10719703, lire en ligne)
- ↑ (en) Daniela Giustarini, Aldo Milzani, Isabella Dalle-Donne et Ranieri Rossi, « Detection of S-nitrosothiols in biological fluids: A comparison among the most widely applied methodologies », Journal of Chromatography B, vol. 851, nos 1-2, , p. 124-139 (PMID 17035104, DOI 10.1016/j.jchromb.2006.09.031, lire en ligne)
- ↑ (en) Jesper J. Hedberg, William J. Griffiths, Stina J. F. Nilsson et Jan-Olov Höög, « Reduction of S-nitrosoglutathione by human alcohol dehydrogenase 3 is an irreversible reaction as analysed by electrospray mass spectrometry », The FEBS Journal, vol. 270, no 6, , p. 1249-1256 (PMID 12631283, DOI 10.1046/j.1432-1033.2003.03486.x, lire en ligne)
- ↑ (en) David E. Jensen, George K. Belka et Garrett C. du Bois, « S-Nitrosoglutathione is a substrate for rat alcohol dehydrogenase class III isoenzyme », Biochemical Journal, vol. 331, no 2, , p. 659-668 (PMID 9531510, PMCID 1219401, DOI 10.1042/bj3310659, lire en ligne)
- ↑ (en) Claudia A. Staab, Johan Ålander, Ralf Morgenstern, Roland C. Grafström et Jan-Olov Höög, « The Janus face of alcohol dehydrogenase 3 », Chemico-Biological Interactions, vol. 178, nos 1-3, , p. 29-35 (PMID 19038239, DOI 10.1016/j.cbi.2008.10.050, lire en ligne)
- ↑ (en) Pascale F. Dijkers et Patrick H. O'Farrell, « Dissection of a Hypoxia-induced, Nitric Oxide–mediated Signaling Cascade », Molecular Biology of the Cell, vol. 20, no 18, , p. 4083-4090 (PMID 19625446, PMCID 2743626, DOI 10.1091/mbc.E09-05-0362, lire en ligne)
- ↑ (en) Brian Lima, Michael T. Forrester, Douglas T. Hess et Jonathan S. Stamler, « S-Nitrosylation in Cardiovascular Signaling », Circulation Research, vol. 106, no 4, , p. 633-646 (PMID 20203313, PMCID 2891248, DOI 10.1161/CIRCRESAHA.109.207381, lire en ligne)
- ↑ (en) Behrad Derakhshan, Gang Hao et Steven S. Gross, « Balancing reactivity against selectivity: The evolution of protein S-nitrosylation as an effector of cell signaling by nitric oxide », Cardiovascular Research, vol. 75, no 2, , p. 210-219 (PMID 17524376, PMCID 1994943, DOI 10.1016/j.cardiores.2007.04.023, lire en ligne)
- ↑ (en) Douglas T. Hess, Akio Matsumoto, Sung-Oog Kim, Harvey E. Marshall et Jonathan S. Stamler, « Protein S-nitrosylation: purview and parameters », Nature Reviews, vol. 6, no 2, , p. 150-166 (PMID 15688001, DOI 10.1038/nrm1569, lire en ligne)
- ↑ (en) Darren P. Casey, Darren T. Beck et Randy W. Braith, « Systemic plasma levels of nitrite/nitrate (NOx) reflect brachial flow-mediated dilation responses in young men and women », Clinical and Experimental Pharmacology and Physiology, vol. 34, no 12, , p. 1291-1293 (PMID 17973870, DOI 10.1111/j.1440-1681.2007.04715.x, lire en ligne)
- ↑ (en) Peter Ganz et Joseph A. Vita, « Testing Endothelial Vasomotor Function. Nitric Oxide, a Multipotent Molecule », Circulation, vol. 108, no 17, , p. 2049-2053 (PMID 14581383, DOI 10.1161/01.CIR.0000089507.19675.F9, lire en ligne)
- ↑ (en) Loretta G. Que, Limin Liu, Yun Yan, Gregory S. Whitehead, Stephen H. Gavett, David A. Schwartz et Jonathan S. Stamler Protection from Experimental Asthma by an Endogenous Bronchodilator, « Protection from experimental asthma by an endogenous bronchodilator », Science, vol. 308, no 5728, , p. 1618-1621 (PMID 15919956, PMCID 2128762, DOI 10.1126/science.1108228, lire en ligne)
- ↑ (en) Ashley H. Snyder, Marianne E. McPherson, John F. Hunt, Michael Johnson, Jonathan S. Stamler et Benjamin Gaston, « Acute Effects of Aerosolized S-Nitrosoglutathione in Cystic Fibrosis », American Journal of Respiratory and Critical Care Medicine, vol. 165, no 7, , p. 922-926 (PMID 11934715, DOI 10.1164/ajrccm.165.7.2105032, lire en ligne)
