Synthèse de quinoléine de Camps
La synthèse de quinoléine de Camps, cyclisation de Camps[1] ou simplement réaction de Camps est une réaction chimique où une o-acylaminoacétophénone est transformée en deux hydroxyquinoléines différentes en utilisant un ion hydroxyde[2],[3],[4],[5],[6],[7],[8] :
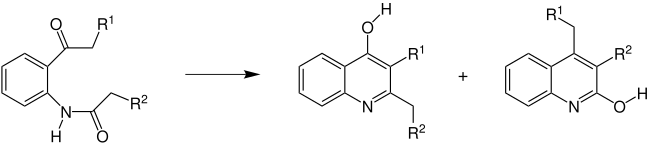
où R1 et R2 sont des groupes organyle identiques ou différents, ou des atomes d'hydrogène. La réaction peut donc être réalisée avec, par exemple, des dérivés ortho-aminés de l'acétophénone, de la benzophénone, de l'acétate de benzyle ou de la propiophénone, et donne lieu à un mélange des deux produits. Cependant, si l'un de ces radicaux a des propriétés de électroattractrices, (par exemple un groupe cyano, acyle ou phényle), un seul produit sera formé[9] : si R1 est électroattracteur, la 4-hydroxyquinoléine (gauche) sera formée, si c'est R2, ce sera la 2-hydroxyquinoléine (droite).
Histoire
[modifier | modifier le code]Le principe de la réaction a été découvert par le chimiste italien Icilio Guareschi (1847-1918) en 1894[9]. Guareschi avait fait réagir l'ortho-aminoacétophénone avec le cyanoacétate d'éthyle dans une réaction de condensation produisant la 2-hydroxy-3-cyano-4-méthylquinoléine. Cette réaction a ensuite été étendue par Rudolf Camps pour synthétiser des hydroxyquinoléines en faisant réagir des N-acyl-ortho-acylanilines avec une base.
Mécanisme réactionnel
[modifier | modifier le code]La réaction produisant deux composés, deux mécanismes entrent en jeu de façon concurrente, en fonction du lieu de la déprotonation.
Formation de 2,3-dialkyl-4-hydroxyquinoléine
[modifier | modifier le code]Ce produit est formé lors de la déprotonation du groupe méthylène au niveau du radical R1, c'est-à-dire lorsque R1 est un radical électroattracteur ou qu'un mélange des deux produits est formé[9],[10] :
Tout d'abord, la base déprotonise le groupe méthylène de la N-acyl-ortho-acylaniline (1), formant ainsi un énolate (2). Le groupe carbonyle se reforme, et la double liaison C=C qui vient d'être formée va attaquer de manière nucléophile l'atome de carbone de l'autre groupe carbonyle, formant ainsi un hétérocycle à six (3). Le groupe alcoolate de cet intermédiaire va alors réagir avec la base protonnée pour former un alcool (4). Ce même groupe va finalement arracher le proton du groupe amine voisin et partir, formant une imine cyclique (5). Cette dernière va enfin se réorganiser par un équilibre de tautomérisation céto-énolique pour former la 2,3-dialkyl-4-hydroxyquinoléine (6).
Formation de 3,4-dialkyl-2-hydroxyquinoléine
[modifier | modifier le code]La 3,4-dialkyl-2-hydroxyquinoléine est elle formée lorsque le groupe méthylène du groupe aminoacyle est déprotoné , c'est-à-dire lorsque R2 est électroattracteur ou qu'un mélange des deux produits est formé[9],[10] :
Dans ce cas de figure, c'est le groupe méthylène porté par le groupe amide (1) qui est déprotoné par la base. Ici aussi, l'énolate formé se retransforme en carbonyle, la double liaison C=C attaquant l'atome de carbone du groupe acyle et forme un hétérocycle à six (8). L'alcoolate résultant se reprotonise (9), puis est éliminé (réaction de déshydratation) en laissant une liaison double C=C. Ce dernier intermédiaire (10) se réorganise par tautomérisme pour former la 3,4-dialkyl-2-hydroxyquinoléine (11).
Exemple
[modifier | modifier le code]La réaction de Camps put être utilisée pour produire le 2-phénylquinoléin-4-ol/2-phényl-4-quinolone :

Notes et références
[modifier | modifier le code]- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Camps-Chinolinsynthese » (voir la liste des auteurs).
- ↑ C. P. Jones, K. W. Anderson, S. L. Buchwald, « Sequential Cu-Catalyzed Amidation-Base-Mediated Camps Cyclization: A Two-Step Synthesis of 2-Aryl-4-quinolones from o-Halophenones », J. Org. Chem., vol. 72, no 21, , p. 7968–7973 (DOI 10.1021/jo701384n)
- ↑ (de) Camps, Rudolf, « Synthese von α- und γ-Oxychinolinen », Archiv der Pharmazie, vol. 237, no 9, , p. 659–691 (DOI 10.1002/cber.18990320389)
- ↑ (de) Camps, Rudolf, « Synthese von α- und γ-Oxychinolinen », Ber., vol. 32, no 31, , p. 3228-3234 (DOI 10.1002/ardp.18992370902)
- ↑ (de) Camps, Rudolf, « Synthese von α- und γ-Oxychinolinen », Archiv der Pharmazie, vol. 239, no 8, , p. 591–610 (DOI 10.1002/ardp.19012390805)
- ↑ (de) R. Camps, « Von der Amidophenylpropiolsäure zur Kynurensäure und deren Verwandten », Berichte der deutschen chemischen Gesellschaft, vol. 34, no 2, , p. 2703–2718 (DOI 10.1002/cber.190103402221)
- ↑ (de) R. Camps, « Synthese von α- und γ-Oxychinolinen », Archiv der Pharmazie, vol. 240, no 2, , p. 135–146 (DOI 10.1002/ardp.19022400204)
- ↑ R. H. Manske, « The Chemistry of Quinolines », Chem. Rev., vol. 30, no 1, , p. 113–144 (DOI 10.1021/cr60095a006)
- ↑ C. P. Jones, K. W. Anderson, S. L. Buchwald, « Sequential Cu-Catalyzed Amidation-Base-Mediated Camps Cyclization: A Two-Step Synthesis of 2-Aryl-4-quinolones from o-Halophenones », J. Org. Chem., vol. 72, no 21, , p. 7968–7973 (DOI 10.1021/jo701384n)
- Z. Wang, Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, 0John Wiley & Sons, Hoboken, New Jersey, , 3824 p. (ISBN 978-0-471-70450-8), p. 598–602
- J. J. Li, Name Reactions. A Collection of Detailed Reaction Mechanisms : 3e édition étendue, Berlin/Heidelberg, Springer, , 104–106 p. (ISBN 978-3-540-30030-4)

