Thiocyanate de cuivre(I)
| Thiocyanate de cuivre(I) | |
| |
| Identification | |
|---|---|
| Synonymes |
thiocyanate cuivreux |
| No CAS | |
| No ECHA | 100.012.894 |
| No CE | 214-183-1 |
| PubChem | 11029823 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche à jaune pâle[1] |
| Propriétés chimiques | |
| Formule | CuSCN |
| Masse molaire[2] | 121,628 ± 0,009 g/mol C 9,87 %, Cu 52,25 %, N 11,52 %, S 26,36 %, |
| Propriétés physiques | |
| T° fusion | 1 084 °C[3] |
| Solubilité | pratiquement insoluble dans eau, alcool ; soluble dans ammoniaque, éther[3] |
| Masse volumique | 2,84 g·cm-3[3] |
| Propriétés électroniques | |
| Largeur de bande interdite | 3,6 eV |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le thiocyanate de cuivre(I) est un polymère de coordination (en) (polymère de coordination) de formule chimique CuSCN. Il se présente sous la forme d'une poudre blanche à jaune pâle, stable à l'air. Il est notamment utilisé comme précurseur dans la préparation de sels de thiocyanate.
Structure
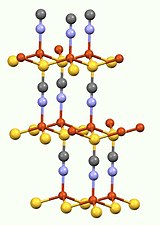
[modifier | modifier le code]Deux polymorphes ont été caractérisés[réf. nécessaire]. Dans la forme en illustration, le cuivre(I) possède une géométrie de coordination tétraédrique caractéristique. La terminaison soufre du ligand SCN- est triplement pontante[4].
Synthèse
[modifier | modifier le code]Le thiocyanate de cuivre(I) est formé lors de la décomposition spontanée du thiocyanate de cuivre(II) anhydre, un solide noir, libérant au passage du thiocyanogène (en), en particulier lorsqu'il est chauffé. Il est également formé lorsque le thiocyanate de cuivre(II) est plongé dans l'eau, libérant, entre autres, de l'acide thiocyanique et le hautement toxique cyanure d'hydrogène[5].
Il peut être préparé en pratique à partir de solutions aqueuses de cuivre(II), telles du sulfate de cuivre(II), en y ajoutant de l'acide sulfurique puis une forme soluble de thiocyanate, de préférence lentement, en agitant[6]. Le thiocyanate de cuivre(I) précipite alors, sous la forme d'une poudre blanche[7]. Alternativement, une solution de thiosulfate peut être utilisée comme agent réducteur.
Sels doubles
[modifier | modifier le code]Le thiocyanate de cuivre(I) forme un sel double avec le césium, CsCu(SCN)2, qui ne peut être obtenu qu'à partir d'une solution concentrée de thiocyanate de césium (CsSCN), dans laquelle est dissous CuSCN. Dans des solutions moins concentrées, du CuSCN solide se sépare, montrant ainsi sa faible solubilité[8].
CuSCN ne forme pas de sels doubles avec les autres éléments du groupe 1 ; dans des conditions similaires (dissolution de CuSCN dans des solutions de thiocyanate de potassium, de sodium ou de baryum (de), portées à cristallisation en concentrant la solution), des sels mixtes se forment, qui ne sont cependant pas considérés comme des sels doubles. En effet, lorsque ces sels mixtes sont redissous ou que leur solution est diluée, du thiocyanate de cuivre(I) se sépare[5].
Utilisations
[modifier | modifier le code]Semi-conducteur
[modifier | modifier le code]Le thiocyanate de cuivre(I) est un semi-conducteur de type P (ses porteurs majoritaires sont des trous), à large gap (3,6 eV, donc transparent à la lumière visible et à l'infrarouge proche)[9]. Il est utilisé en photovoltaïque dans certaines cellules de troisième génération comme couche à transfert de trous. Il est couramment utilisé dans les cellules solaires à pigment photosensible. Sa conductivité des trous est cependant assez faible (0,01 S m−1) mais peut être augmentée par divers traitements, notamment par exposition au dichlore ou par dopage au (SCN)2[10].
CuSCN est également utilisé comme dopant de la pérovskite dans les cellules photovoltaïques à pérovskites en remplacement de composés plus onéreux tels le spiro-OMeTAD, même si le rendement est alors moindre (de l'ordre de 20 %)[11].
Autres
[modifier | modifier le code]Le thiocyanate de cuivre(I) en association avec l'oxyde de nickel(II) (NiO) est utilisé comme additif suppresseur de fumée dans le PVC.
CuSCN précipité sur un support de carbone peut être utilisé dans la conversion d'halogénures d'aryle en thiocyanates d'aryle[12].
Le thiocyanate de cuivre(I) est utilisé dans certaines pentures antifoulings[13],[14]. Comparé à l'oxyde de cuivre, CuSCN présente l’avantage d'être blanc et d'être un biocide plus efficace.
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Copper(I) thiocyanate » (voir la liste des auteurs).
- Oxford University Chemical Safety Data, « copper(I) thiocyanate », sur ChemSpider
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Copper(I) thiocyanate, 96% min », sur Alfa Aesar (consulté le ).
- Smith, D. L., Saunders, V. I., Preparation and Structure Refinement of the 2H Polytype of beta-Copper(I) Thiocyanate, Acta Crystallographica B, 1982, vol. 38, 907-909, DOI 10.1107/S0567740882004361
- Herbert E. Williams, The chemistry of cyanogen compounds, Londres, J. & A. Churchill, , 202–203 p.
- Matthew Dick, « Use of cuprous thiocyanate as a short-term continuous marker for faeces », Gut, vol. 10, , p. 408–412 (408) (DOI 10.1136/gut.10.5.408)
- Reece H. Vallance, Douglas F. Twiss et Annie R. Russell, A text-book of inorganic chemistry, vol. VII, J. B. Lippincott Company, , 282 p., partie II
- H.L. Wells, « On some double and triple thiocyanates », American Chemical Journal, vol. 28, , p. 245–284 (263)
- Wilde, G., Nanostructured Materials, Elsevier Science, , 384 p. (ISBN 978-0-08-091423-7, lire en ligne), p. 256
- Albini, A., Fausto, R., de Melo, J.S.S., Maldotti, A., Clementi, C., Kalyanasundaram, K., Johnston, L.J., Harbron, E., Misawa, H. et Romani, A., Photochemistry, Royal Society of Chemistry, , 294 p. (ISBN 978-1-84973-165-2, lire en ligne), p. 164
- N. Arora et al., Science, vol. 358, p. 768-771, 2017.
- Clark, J.H., Kybett, A.P. et Macquarrie, D.J., Supported Reagents : Preparation, Analysis, and Applications, Wiley, , 168 p. (ISBN 978-0-471-18779-0, lire en ligne), p. 121
- « Copper in Antifouling », sur copperantifouling.com via Wikiwix (consulté le ).
- V.F. Vetere et al., Solubility and Toxic Effect of the Cuprous Thiocyanate Antifouling Pigment on Barnacle Larvae, Journal of Coatings Technology, 69:39, mars 1997, https://link.springer.com/article/10.1007/BF02696144