ARNr 5S
| ARNr 5S | |
|---|---|
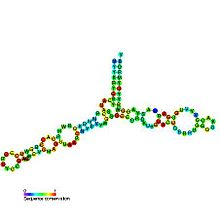 Estrutura secundaria predita e conservación de secuencia do ARNr 5S | |
| Identificadores | |
| Rfam | RF00001 |
| Outros datos | |
| Dominio(s) | Eukaryota; Bacteria; Archaea |
| GO | 0005840 0003735 |
| Estruturas PDB | PDBe |
O ARNr 5S (ou 5S rRNA) é un ARN ribosómico de aproximadamente 120 nucleótidos de longo cunha masa de 40 kDa, que é un compoñente estrutural e funcional da subunidade maior (de 50S) dos ribosomas de bacterias, arqueas e eucariotas, coa excepción dos ribosomas mitocondriais de fungos e animais. A denominación 5S débese a que esa é a velocidade de sedimentación da molécula nunha ultracentrífuga, medida en unidades svedberg (S).[1]

Biosíntese
[editar | editar a fonte]En procariotas, o xene do ARNr 5S está localizado nos operóns de ARNr e está situado augas abaixo dos xenes dos ARNr das subunidades ribosómicas maior e menor e é cotranscrito formando un precursor policistrónico.[3] Unha particularidade dos xenomas nucleares eucariotas é a presenza de múltiples copias do xene do ARNr 5S (ADNr 5S) agrupados en repeticións en tándem, cuxo número de copias varía entre especies.[4][5] O ARNr 5S eucariota é sintetizado pola ARN polimerase III, mentres que outros ARNr eucariotas son escindidos a partir dun precursor de 45S transcrito pola ARN polimerase I. En ovocitos de Xenopus observouse que os "dedos" 4-7 do factor de transcrición de nove dedos de cinc TFIIIA poden unirse á rexión central do ARNr 5S.[6][7] A unión entre o ARNr 5S e o TFIIIA serve tanto para reprimir máis transcrición do xene de ARNr 5S como para estabilizar o transcrito de ARNr 5S ata que se require para a ensamblaxe do ribosoma.[8]
Estrutura
[editar | editar a fonte]A estrutura secundaria do ARNr 5S consiste en cinco hélices (denominadas do I ao V en números romanos), catro bucles (B-E) e unha bisagra (A), que xuntos forman unha estrutura con forma de Y. Os bucles C e D son forquitas terminais e os bucles B e E son internos.[4] Segundo estudos filoxenéticos, as hélices I e III son probablemente ancestrais.[9] A hélice III comprende dúas adenosinas conservadas.[10] A hélice V, coa súa estrutura en forquita, crese que interacciona co TFIIIA.[4]
Localización no ribosoma
[editar | editar a fonte]
Usando diversas técnicas moleculares, como a microscopia inmunoelectrónica, enlaces cruzados químicos intermoleculares e cristalografía de raios X, determinouse con gran precisión a localización do ARNr 5S dentro da subunidade ribosómica maior. En bacterias e arqueas, a propia subunidade ribosómica maior (LSU) está composta por dúas moléculas de ARNr, o ARNr 5S e o ARNr 23S, xunto con numerosas proteínas asociadas.[3] En eucariotas, a subunidade ribosómica maior contén os ARNr 5S, 5,8S e 28S e aínda máis proteínas.[12][13] A estrutura tridimensional da subunidade ribosómica maior mostra unha superficie relativamente lisa por un lado e unha superficie oposta con tres proxeccións, especialmente a protberancia L1, a protuberancia central (CP) e o talo L7/L12. A protuberancia L1 e o talo L7/L12 están dispostos rodeando laterlmente a protuberancia central. O ARNr 5S está localizado na protuberancia central e participa na formación e na estrutura desta proxección. Os outros constituíntes principais da protuberancia central son o ARNr 23S (ou alternativamente o 28S en eucariotas) e varias proteinas como L5, L18, L25 e L27.[14]
Funcións ribosómicas
[editar | editar a fonte]A función exacta desempeñada polo ARNr 5S non está aínda clara. En Escherichia coli, as delecións no xene do ARNr 5S reducen a taxa de síntese proteica e teñen un efecto negativo máis profundo sobre as condicións reinantes na célula que as delecións dun número comparable de copias doutros xenes de ARNr (16S e 23S).[15] Os estudos cristalográficos indican que as proteínas que se unen ao ARNr 5S e outras proteínas da protuberancia central da subunidade ribosómica maior xogan un papel na unión dos ARNt.[14] Ademais, a proximidade topográfica e física entre o ARNr 5S e o 23S, que forma a peptidil trnasferase e o centro de asociación da GTPase, suxire que o ARNr 5S actúa como un mediador entre os dous centros funcionais do ribosoma ao formar, xunto coas proteínas que se unen ao ARNr 5S e outros compoñentes da protuberancia central, pontes intersubunidades e sitios de unión do ARNt.[14]
Papel na ensamblaxe dos ribosomas
[editar | editar a fonte]En eucariotas, o ribosoma citosólico ensámblase a partir de catro ARNr e unhas 80 proteínas.[13][16] Unha vez transcrito, os extremos 3' do ARNr 5S son procesados polas exonucleases Rex1p, Rex2p e Rex3p.[4] As subunidades ribosómicas de 60S e 40S son exportadas desde o núcleo ao citoplasma, onde se unen para formar o ribosoma de 80S maduro e competente para facer a tradución de proteínas. Segue sendo moi discutido cal é o momento en que O ARNr 5S se integra no ribosoma,[4] pero acéptase en xeral que o ARNr 5S se incorpora á particula de 90S, que é a precursora da partícula de 60S, como parte dun complexo ribonucleoproteínico independente do ribosoma formado polo ARNr 5S e a proteína ribosómica L5.[16]
Interaccións con proteínas
[editar | editar a fonte]Varias proteínas importantes que interaccionan co ARNr 5S son as seguintes:
Proteína La
[editar | editar a fonte]A interacción do ARNr 5S coa proteína La impide a degradación do ARN por exonucleases na célula.[17] A proteína La encóntrase no núcleo de todos os organismos eucariotas e asóciase con varios tipos de ARNr transcritos pola ARN pol III. A proteína La interacciona con estes ARN (incluíndo o ARNr 5S) por medio do seu tracto de 3' oligo-uridina, colaborando na estabilidade e pregamento do ARN.[4][18]
Proteína L5
[editar | editar a fonte]En células eucariotas, a proteína ribosómica L5 asóciase e estabiliza o ARNr 5S formando unha partícula ribonuleoproteica prerribosómica (RNP) que se encontra tanto no citosol coma no núcleo. A deficiencia de L5 impide o transporte do ARNr 5S co núcleo e ten como resultado unha diminución na ensamblaxe ribosómica.[4]
Outras proteínas ribosómicas
[editar | editar a fonte]En procariotas o ARNr 5S únese ás proteínas ribosómicas L5, L18 e L25, mentres que nos eucariotas o ARNr 5S é só se sabe que se une á proteína ribosómica L5.[19] En Trypanosoma brucei, o axente causante da tripanosomíase africana (enfermidade do sono), o ARNr 5S interacciona con dúas proteínas que se unen ao ARN estreitamente relacionadas, a P34 e a P37, cuxa perda ten como resultado un menor nivel global de ARNr 5S.[4]
Presenza en ribosomas
[editar | editar a fonte]| ARNr 5S | |
|---|---|
| Identificadores | |
| Rfam | RF02547 |
| Outros datos | |
| Dominio(s) | Eukaryota; |
| GO | 0005840 0003735 |
| Estruturas PDB | PDBe |

As maquinarias de tradución de proteínas das mitocondrias e plastidios (orgánulos de orixe bacteriana endosimbiótica) e os seus correspondentes bacterianos comparten moitas características, mais tamén tañen marcadas diferenzas. Os xenomas dos orgánulos codifican os ARNr das subunidades menor e maior do ribosoma sen excepción, aínda que a distribución dos xenes do ARNr 5S (rrn5) é máis desigual. O rrn5 identifícase doadamente e é común nos xenomas da maioría dos plastidios. En contraste, o rrn5 mitocondrial parecía que inicialmente estaba restrinxido a plantas e un pequeno número de protistas.[20][21] Ademais, poden identificarse algúns ARNr 5S organulares máis diverxentes só con modelos de covarianza especializada que incorporan información sobre o nesgo pronunciado na composición de secuencia e variación estrutural.[22] Esta análise localiza xenes de ARNr 5S adicionais non só en xenomas de mitocondrias da maioría das liñaxes de protistas, senón tamén en xenomas de certos apicoplastos (plastidios non fotosintéticos de protozoos patóxenos como Toxoplasma gondii e Eimeria tenella).

Os ARNr 5S mitocondriais da maioría das estramenopiles comprenden a maior diversidade de estruturas secundarias.[22] Os ARNr 5S mitocondriais permutados das algas pardas representan o caso menos convencional, no que a hélice I de peche, que normalmente une os extremos 5' e 3' da molécula, é substituída por unha forquita (pechada) que orixina como resultado unha unión de tres vías aberta.
As probas existentes actualmente indican que o ADN mitocondrial de só uns poucos grupos, singularmente os animais, fungos, alveolados e euglenozoos carece do xene.[22] A protuberancia central, que normalmente está ocupada polo ARNr 5S e as súas proteinas asociadas (ver Figura 2), foi remodelado de varios xeitos. Nos ribosomas mitocondriais fúnxicos, o ARNr 5S é substituído por secuencias de expansión do ARNr da subunidade maior.[23] En cinetoplástidos (euglenozoos), a protuberancia central está formada enteiramente por proteínas do ribosoma mitocondrial evolutivamente novas.[24] Finalmente, os ribosomas mitocondriais animais incorporaron un ARNt mitocondrial específico para substituír o ARNr 5S perdido.[25][26]
Notas
[editar | editar a fonte]- ↑ Szymanski M, Barciszewska MZ, Erdmann VA, Barciszewski J (January 2002). "5S Ribosomal RNA Database". Nucleic Acids Res. 30 (1): 176–8. PMC 99124. PMID 11752286. doi:10.1093/nar/30.1.176.
- ↑ Mueller F, Sommer I, Baranov P, Matadeen R, Stoldt M, Wöhnert J, Görlach M, van Heel M, Brimacombe R (2000). "The 3D arrangement of the 23 S and 5 S rRNA in the Escherichia coli 50 S ribosomal subunit based on a cryo-electron microscopic reconstruction at 7.5 A resolution". J Mol Biol 298 (1): 35–59. PMID 10756104. doi:10.1006/jmbi.2000.3635.
- ↑ 3,0 3,1 Kaczanowska, M; Rydén-Aulin, M (September 2007). "Ribosome biogenesis and the translation process in Escherichia coli". Microbiology and Molecular Biology Reviews 71 (3): 477–494. PMC 2168646. PMID 17804668. doi:10.1128/MMBR.00013-07.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 Ciganda, Martin; Williams, Noreen (July 2011). "Eukaryotic 5S rRNA biogenesis". Wiley Interdisciplinary Reviews: RNA 2 (4): 523–533. PMC 3278907. PMID 21957041. doi:10.1002/wrna.74.
- ↑ Douet, J; Tourmente, S (Jul 2007). "Transcription of the 5S rRNA heterochromatic genes is epigenetically controlled in Arabidopsis thaliana and Xenopus laevis". Heredity 99 (1): 5–13. PMID 17487217. doi:10.1038/sj.hdy.6800964.
- ↑ McBryant, SJ; Veldhoen, N; Gedulin, B; Leresche, A; Foster, MP; Wright, PE; Romaniuk, PJ; Gottesfeld, JM (1995). "Interaction of the RNA binding fingers of Xenopus transcription factor IIIA with specific regions of 5 S ribosomal RNA". Journal of Molecular Biology 248 (1): 44–57. PMID 7731045. doi:10.1006/jmbi.1995.0201.
- ↑ Searles, MA; Lu D; Klug A (2000). "The role of the central zinc fingers of transcription factor IIIA in binding to 5 S RNA". J Mol Biol 301 (1): 47–60. PMID 10926492. doi:10.1006/jmbi.2000.3946.
- ↑ Pelham, HRB; Brown DD (1980). "A specific transcription factor that can bind either the 5S RNA gene or 5S RNA". Proc. Natl. Acad. Sci. USA 77 (7): 4170–4174. PMC 349792. PMID 7001457. doi:10.1073/pnas.77.7.4170.
- ↑ Sun, FJ; Caetano-Anollés, G (Nov 2009). "The evolutionary history of the structure of 5S ribosomal RNA". Journal of Molecular Evolution 69 (5): 430–43. PMID 19639237. doi:10.1007/s00239-009-9264-z.
- ↑ DiNitto, JP; Huber, PW (Oct 23, 2001). "A role for aromatic amino acids in the binding of Xenopus ribosomal protein L5 to 5S rRNA". Biochemistry 40 (42): 12645–53. PMID 11601989. doi:10.1021/bi011439m.
- ↑ Ban N, Nissen P, Hansen J, Moore P, Steitz T (2000). "The complete atomic structure of the large ribosomal subunit at 2.4 Å resolution". Science 289 (5481): 905–20. PMID 10937989. doi:10.1126/science.289.5481.905.
- ↑ Turowski, TW; Tollervey, D (2015). "Cotranscriptional events in eukaryotic ribosome synthesis". Wiley Interdisciplinary Reviews: RNA 6 (1): 129–139. PMID 25176256. doi:10.1002/wrna.1263.
- ↑ 13,0 13,1 Yusupova, G; Yusupov, M (February 2014). "High-resolution structure of the eukaryotic 80S ribosome". Annual Review of Biochemistry 83: 467–486. PMID 24580643. doi:10.1146/annurev-biochem-060713-035445.
- ↑ 14,0 14,1 14,2 Gongadze, G. M. (7 January 2012). "5S rRNA and ribosome". Biochemistry (Moscow) 76 (13): 1450–1464. PMID 22339598. doi:10.1134/S0006297911130062.
- ↑ Ammons, D; Rampersad, J; Fox, GE (Jan 15, 1999). "5S rRNA gene deletions cause an unexpectedly high fitness loss in Escherichia coli". Nucleic Acids Research 27 (2): 637–42. PMC 148226. PMID 9862991. doi:10.1093/nar/27.2.637.
- ↑ 16,0 16,1 Henras, AK; Soudet, J; Gérus, M; Lebaron, S; Caizergues-Ferrer, M; Mougin, A; Henry, Y (Aug 2008). "The post-transcriptional steps of eukaryotic ribosome biogenesis". Cellular and Molecular Life Sciences 65 (15): 2334–59. PMID 18408888. doi:10.1007/s00018-008-8027-0.
- ↑ Wolin, SL; Cedervall, T (2002). "The La protein". Annual Review of Biochemistry 71: 375–403. PMID 12045101. doi:10.1146/annurev.biochem.71.090501.150003.
- ↑ Maraia, RJ; Intine, RV (2002). "La protein and its associated small nuclear and nucleolar precursor RNAs". Gene Expression 10 (1–2): 41–57. PMC 5977531. PMID 11868987.
- ↑ Moore PB (March 2001). "The ribosome at atomic resolution". Biochemistry 40 (11): 3243–50. PMID 11258942. doi:10.1021/bi0029402.
- ↑ Bullerwell, CE; Schnare, MN; Gray, MW (March 2003). "Discovery and characterization of Acanthamoeba castellanii mitochondrial 5S rRNA". RNA 9 (3): 287–292. PMC 1370395. PMID 12592002. doi:10.1261/rna.2170803.
- ↑ Bullerwell, CE; Burger, G; Gott, JM; Kourennaia, O; Schnare, MN; Gray, MW (May 2010). "Abundant 5S rRNA-like transcripts encoded by the mitochondrial genome in Amoebozoa". Eukaryot Cell 9 (5): 762–773. PMC 2863963. PMID 20304999. doi:10.1128/EC.00013-10.
- ↑ 22,0 22,1 22,2 Valach, M; Burger, G; Gray, MW; Lang, BF (Dec 2014). "Widespread occurrence of organelle genome-encoded 5S rRNAs including permuted molecules". Nucleic Acids Res. 42 (22): 13764–13777. PMC 4267664. PMID 25429974. doi:10.1093/nar/gku1266.
- ↑ Amunts, A; Brown, A; Bai, XC; Llácer, JL; Hussain, T; Emsley, P; Long, F; Murshudov, G; Scheres, SH; Ramakrishnan, V (March 2014). "Structure of the yeast mitochondrial large ribosomal subunit". Science 343 (6178): 1485–1489. PMC 4046073. PMID 24675956. doi:10.1126/science.1249410.
- ↑ Sharma, MR; Booth, TM; Simpson, L; Maslov, DA; Agrawal, RK (Jun 2009). "Structure of a mitochondrial ribosome with minimal RNA". Proc Natl Acad Sci U S A 106 (24): 9637–9642. PMC 2700991. PMID 19497863. doi:10.1073/pnas.0901631106.
- ↑ Brown, A; Amunts, A; Bai, XC; Sugimoto, Y; Edwards, PC; Murshudov, G; Scheres, SH; Ramakrishnan, V (Nov 2014). "Structure of the large ribosomal subunit from human mitochondria". Science 346 (6210): 718–722. PMC 4246062. PMID 25278503. doi:10.1126/science.1258026.
- ↑ Greber, BJ; Boehringer, D; Leibundgut, M; Bieri, P; Leitner, A; Schmitz, N; Aebersold, R; Ban, N (Nov 2014). "The complete structure of the large subunit of the mammalian mitochondrial ribosome". Nature 515 (7526): 283–286. PMID 25271403. doi:10.1038/nature13895. hdl:20.500.11850/93239.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Páxina para o 5S ribosomal RNA en Rfam
- 5SDataArquivado 27 de abril de 2010 en Wayback Machine.
- 5S Ribosomal RNA Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.