Bdeloideos
| Bdeloideos (rotíferos) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Imaxe de microscopio de varrido de varios rotíferos bdeloideos e as súas mandíbulas | |||||||||
| Clasificación científica | |||||||||
| |||||||||
Os bdeloideos (Bdelloidea), do grego βδελλα, bdella, "sambesuga", é unha clase de rotíferos que viven en augas doces de todo o mundo. Describíronse unhas 450 especies de rotíferos bdeloideos, que se distinguen entre si principalmente pola súa morfoloxía.[1] As principais características que distinguen os bdeloideos dos grupos de rotíferos relacionados son exclusivamente a reprodución partenoxenética e a súa capacidade de sobreviviren en ambientes secos e rigorosos ao entraren nun estado de dormencia inducida polo desecamento (anhidrobiose) en calquera dos seus estadios vitais.[2] Con frecuencia denomínanse os "asexuais antigos" debido á súa peculiar historia asexual que comprende os últimos 25 millóns de anos de rexistro fósil.[3] Os rotíferos bdeloideos son organismos pluricelulares microscópicos, que miden xeralmente entre 150 e 700 µm de lonxitude.[2] A maioría son só un pouco máis pequenos do necesario para poder verse a simple vista, pero vense como pequenos puntos brancos usando unha lupa de pouco aumento, especialmente con luz brillante.
Relacións evolutivas
[editar | editar a fonte]O filo Rotifera tradicionalmente incluía tres clases: Bdelloidea, Monogonononta e Seisonidea.[4] Antes de 1990 os estudos filoxenéticos baseados na morfoloxía parecían indicar que o grupo irmán dos rotíferos bdeloideos era o dos monogonontes, mentres que os rotíferos seisónidos eran un grupo externo (outgroup) que se separou cedo.[5]

Os estudos modernos de filoxenética molecular demostran que esta idea clásica dos 'Rotifera' é incompleta (parafilética), porque omite un cuarto clado de organismos estreitamente relacionados: os Acanthocephala, ou vermes de cabeza espiñenta.[8] Estes, clasificados orixinalmente como un filo separado, presentan evidencias moleculares e morfolóxicas que se acumularon entre 1994 e 2014 que indican que os acantocéfalos forman un grupo monofilético conxuntamente cos Bdelloidea, Monogononta e Seisonidea.[6][9] Para acomodaren estes descubrimentos na clasificación, algúns autores ampliaron o termo 'Rotifera' para incluír aos moi modificados e parasitos 'rotíferos acantocéfalos' xunto cos rotíferos bdeloideos, monogonontes e seisónidos.[10] Outros prefiren chamar ao grupo formado polos catro taxons Syndermata, un termo derivado da súa epiderme sincicial común.[9]
A posición dos Bdelloidea dentro de Syndermata (ou Rotifera) non está enteiramente clara. As relacións filoxenéticas alternativas posibles dentro do clado ilústranse no cladograma mostrado. En 2014, a "análise filoxenómica máis completa das relacións dos sindermatas" feita ata agora estaba baseada en datos do transcritoma dos catro grupos,[6] e proporcionou un "forte apoio" á hipótese ilustrada abaixo á esquerda da figura, na cal Seisonidea e Acanthocephala son taxons irmáns. O estudo indicou ademais que o grupo irmán deste taxon é Bdelloidea, mentres que Monogononta é un grupo externo (outgroup) aos tres. Isto significaría que os parentes máis próximos vivos dos rotíferos bdeloideos non son os rotíferos monogonontes, como se cría previamente, senón os rotíferos seisónidos e os acantocéfalos, malia a súa morfoloxía tan modificada.
Clasificación e identificación
[editar | editar a fonte]A clase Bdelloidea do filo Rotifera consta de tres ordes: Philodinavida, Philodinida e Adinetida. Estas ordes son divididas en catro familias e unhas 450 especies.[11] Como estes organismos son asexuais a definición usual de especie como grupo de organismos con capacidade de crear unha descendencia fértil é inaplicable, polo que o concepto de especie nestes organismos está baseado nunha mestura de datos morfolóxicos e moleculares.
Os bdeloideos só poden identificarse visualmente cando están vivos porque moitas das características significativas para a clasificación están relacionadas coa alimentación e o movemento reptante; con todo, nos individuos mortos é posible facer unha identificación xenética. Unha vez conservados, os individuos contráense formando unha masa informe que restrinxe a posibilidade de análise.[12] Acualmente hai tres metodoloxías de identificación morfolóxica, dúas das cales se consideran anticuadas: Bartôs (1951)[13] e Donner (1965).[11] O terceiro método é un diagnóstico clave desenvolvido en 1995 por Shiel.[12]
Morfoloxía
[editar | editar a fonte]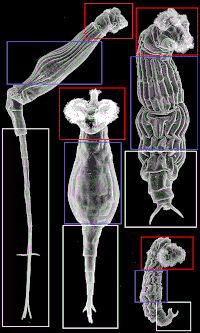
O corpo dos bdeloideos divídese en tres grandes rexións: cabeza, tronco e pé. A imaxe da dereita mostra cada área para ver como as mesmas partes do corpo poden ser moi diferentes dependendo da especie. Os bdeloideos tipicamente teñen unha coroa ciliada ben desenvolvida, dividida en dúas partes, nunha cabeza retraíble.
Algunhas características identificables dos bdeloideos son :
- Glándulas do pé ben desenvolvidas.[12]
- Abertura bucal cun longo esófago[12]
- Fortes dentes (identificados por un índice de dentes).[12]
- Moitos cilios.[12]
- Forma do labio superior específico de especie.[12]
- Tipo de coroa específico da orde.[2]
- Philodinida: a coroa consiste en dous discos ciliados.
- Adinetida: consiste dun campo ciliado ventral.
- Philodinavida: teñen unha coroa pequena.
Os sistemas dixestivo e reprodutor dos bdeloideos poden encontrarse nas seccións do tronco dos seus corpos, e o estómago é o máis visible dos órganos. En certos xéneros, (Habrotrocha, Otostephanos e Scepanotrocha) os bdeloideos poden ser identificados pola aparición de claras boliñas compactadas (pellets) esféricas situados dentro dos estómagos, que serán liberados como feces. Estas boliñas son unha característica distinguible, xa que todos os outros xéneros liberan as feces como materiais soltos (non compactados).[2]
A maioría dos bdeloideos retraen o pé mentres comen, pero hai catro xéneros que carecen de pé, que son: Adineta, Bradyscela, Henoceros e Philodinavus. Isto non só afecta a como se alimentan senón tamén a como reptan; por exemplo, Adineta e Bradyscela escorregan, mentres que os outros xéneros serpentean.[2]
Comportamento
[editar | editar a fonte]O comportamento dos bdeloideos comprende tres aspectos: alimentación, locomoción, reprodución e comportamentos inducidos polo estrés.
Alimentación
[editar | editar a fonte]O comportamento específico dos bdeloideos é variado pero a maioría usa aneis de cilios no órgano da coroa para crear correntes de auga que arrastran a comida a través da boca ata o órgano mástrax, que está adaptado especificamente para triturar a comida.[14] Aliméntanse de bacterias de suspensión, algas, detritos, e outras cousas.
Locomoción
[editar | editar a fonte]Teñen tres métodos principais de movemento: natación libre, reptación como un verme polo substrato, ou son sésiles. A reptación implica dar pasos alternantes coa cabeza e cola, como fan as sambesugas (anélidos), o que lle deu ao grupo o seu nome (do grego βδελλα, bdella, sambesuga). O seguinte vídeo demostra como se moven os bdeloideos en tres situacións diferentes: locomoción e alimentación dos rotíferos bdeloideos.
Reprodución
[editar | editar a fonte]Os bdeloideos son interesantes no estudo da evolución do sexo porque neles nunca se observaron machos,[15] e son todos femias que se reproducen exclusivamente por partenoxénese, unha forma de reprodución asexual na que os embrións crecen e desenvólvense sen necesidade dunha previa fertilización; isto é paracido á apomixe que presentan algunhas plantas.[16] Cada individuo ten gónadas pares. A pesar de que levan sendo asexuais durante millóns de anos, diversificáronse en máis de 450 especies e son case similares a outras especies de rotíferos que se reproducen sexualmente.
Evolución da reprodución partenoxenética obrigada
[editar | editar a fonte]En 2003, o modo de reprodución asexual dos rotíferos bdeloideos era completamente descoñecido.[17] Unha teoría que explicaba como se orxinou a partenoxénese obrigada nos bdeloideos propoñía que as liñaxes partenoxenéticas perdían a capacidade de responder aos sinais indutores do sexo, o que explicaba por que estas liñaxes mantiñan a súa asexualidade.[18] Aínda que se comprobou que as cepas partenoxenéticas obrigadas de rotíferos bdeloideos producen un sinal indutor do sexo, perderon a capacidade de responder a dito sinal. Posteriormente descubriuse que a incapacidade de responder a sinais indutores do sexo en partenóxenos obrigados era causada por simple herdanza mendeliana do xene op. [19]
Comportamento inducido polo estrés
[editar | editar a fonte]Os bdeloideos son capaces de sobrevivir a estreses ambientais ao entraren nun estado de dormencia coñecido como anhidrobiose, que permite aos organismos deshidratarse rapidamente e así resistir ao desecamento. Mentres se preparan para este estado dormente axustan moitos procesos metabólicos para o cambio de estado; por exemplo, a produción de compostos químicos protectores.[20] Os bdeloideos poden permanecer neste estado, que se coñece como 'barril' (tun) ata que volva a haber unha cantidade suficiente de auga, coa que poden rehidratarse e facerse activos en poucas horas. A eclosión dos xoves só ocorre cando as condicións son as máis favorables.[21] Estas formas de dormencia tamén se chaman criptobiose ou quiescencia. Sábese que os bdeloideos poden chegar a sobrevivir nese estado ata 9 anos mentres agardan polo retorno das condicións favorables.[21] En dúas especies de bdeloideos viuse que o estrés de desecamento, ademais de para sobreviviren ao desecamento por medio da anhidrobiose, axuda a manter a fitness e mesmo mellora a fecundidade desas especies. Aos rotíferos que eran mantidos constantemente hidratados íalles peor que aos que eran desecados e rehidratados.[22]
Nos bdeloideos evolucionou un mecanismo exclusivo para axudar a superar un dos maiores perigos da reprodución asexual. Segundo a hipótese da Raíña Vermella da coevolución, os asexuais obrigados acaban extinguíndose por ausa de parasitos e patóxenos que cambian rapidamente, porque non poden cambiar so seus xenotipos o suficientemente rápido para manter o ritmo nesta carreira sen fin. Porén, en poboacións de rotíferos bdeloideos moitos parasitos son destruídos durante os períodos de desecamento ampliados.[23] Ademais, os bdeloideos desecados son facilmente levados polo vento dos hábitats infestados de parasitos, e establecen novas e vigorosas poboacións noutra parte, o que lles permite escapar da Raíña Vermella movéndose no tempo e no espazo en vez de utilizando a reprodución sexual para cambiar o seu xenotipo.[24]
Cando estas criaturas se recuperan do desecamento, sofren un proceso xenético probablemente exclusivo deles no que ocorre unha transferencia horizontal de xenes, o que en como resultado que unha proporción significativa do xenoma dos bdeloideos, de ata o 10%, obtivérona das bacterias, fungos e plantas por esta transferencia horizontal de xenes.[25] A causa e o modo en que ocorre a transferencia horizontal de xenes nos bdeloideos debátese moito actualmente; especialmente con respecto a posibles conexións entre os xenes alleos e o proceso de desecamento e tamén a posibles conexións coa asexualidade antiga dos bdeloideos.
Os rotíferos bdeloideos son extraordinariamente resistentes aos danos producidos pola radiación ionizante debido ás mesmas adaptacións que preservan o ADN utilizadas para sobrevivir á dormencia.[26] Estas adaptacións inclúen un mecanismo extremadamente eficiente para reparar as roturas de dobre febra do ADN.[27] Este mecanismo de reparación foi estudado en dúas especies de bdeloideos: Adineta vaga,[27] e Philodina roseola,[28] e parece implicar a recombinación mitótica entre rexións de ADN homólogas en cada especie.
Galería
[editar | editar a fonte]-
Vista lateral dun bdeloideo.
-
Vista lateral dun bdeloideo.
-
Vista lateral dun bdeloideo en augas ricas en algas.
Notas
[editar | editar a fonte]- ↑ Segers, Hendrick (2007). Annotated checklist of the rotifers (Phylum Rotifera), with notes on nomenclature, taxonomy and distribution (PDF). Auckland: Magnolia Press. ISBN 978-1-86977-129-4.
- ↑ 2,0 2,1 2,2 2,3 2,4 Ricci C (2000). "Key to the identification of the genera of bdelloid rotifers". Hydrobiologia 418: 73–80. doi:10.1023/A:1003840216827.
- ↑ Jr, G. O. Poinar; Ricci, C. (1992-04-01). "Bdelloid rotifers in Dominican amber: Evidence for parthenogenetic continuity". Experientia 48 (4): 408–410. ISSN 0014-4754. doi:10.1007/BF01923444.
- ↑ King, Charles E.; Ricci, Claudia; Schonfeld, Justin; Serra, Manuel (September 2005). "Evolutionary Dynamics of ‘the’ Bdelloid and Monogonont Rotifer Life-history Patterns". Hydrobiologia 546 (1): 55–70. doi:10.1007/s10750-005-4102-9.
- ↑ Wallace, Robert Lee; Colburn, Rebecca Arlene (December 1989). "Phylogenetic relationships within phylum Rotifera: orders and genus Notholca". Hydrobiologia. 186-187 (1): 311–318. doi:10.1007/BF00048926.
- ↑ 6,0 6,1 6,2 Wey-Fabrizius, Alexandra R.; Herlyn, Holger; Rieger, Benjamin; Rosenkranz, David; Witek, Alexander; Welch, David B. Mark; Ebersberger, Ingo; Hankeln, Thomas; Schmitz, Jürgen (10 February 2014). "Transcriptome Data Reveal Syndermatan Relationships and Suggest the Evolution of Endoparasitism in Acanthocephala via an Epizoic Stage". PLoS ONE 9 (2): e88618. doi:10.1371/journal.pone.0088618.
- ↑ Lasek-Nesselquist, Erica (23 August 2012). "A Mitogenomic Re-Evaluation of the Bdelloid Phylogeny and Relationships among the Syndermata". PLoS ONE 7 (8): e43554. doi:10.1371/journal.pone.0043554.
- ↑ Mark Welch, David B. (2001). "Early contributions of molecular phylogenetics to understanding the evolution of Rotifera.". Hydrobiologia. 446/447: 315–322. doi:10.1023/A:1017502923286.
- ↑ 9,0 9,1 Ahlrichs, W. H. (21 March 1997). "Epidermal ultrastructure of Seison nebaliae and Seison annulatus , and a comparison of epidermal structures within the Gnathifera". Zoomorphology 117 (1): 41–48. doi:10.1007/s004350050028.
- ↑ Nielsen, Claus (2012). Animal evolution : interrelationships of the living phyla (3rd ed.). Oxford: Oxford University Press. ISBN 019960603X.
- ↑ 11,0 11,1 Donner, Josef (1965). Ordnung Bdelloidea. Akademie-Verlag. p. 297. ISBN 9789031908851.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 Shiel, R J (1995). A guide to identification of rotifers, cladocerans and copepods from Australian inland waters. Australia: Co-operative Research Centre for Freshwater Ecology. ISBN 0646224107.
- ↑ Bartôs B (1954). "The Czechoslovak Rotatoria of the order Bdelloidea". Memoires de la Societe Zoologique Tchecoslovaque de Prague 15: 241–500.
- ↑ Klusemann J (1990). "The hard parts (trophi) of the rotifer mastax do contain chitin: evidence from studies on Brachionus plicatilis". Histochem. Cell Biol. 94 (3): 277–283. doi:10.1007/bf00266628.
- ↑ Judson, Olivia P.; Normark, Benjamin B. (1996-02-01). "Ancient asexual scandals". Trends in Ecology & Evolution 11 (2): 41–46. PMID 21237759. doi:10.1016/0169-5347(96)81040-8.
- ↑ Milius S. "Bdelloids: No sex for over 40 million years.". TheFreeLibrary. ScienceNews. Consultado o March 2014.
- ↑ Simon, J.-C.; Delmotte, F.; Rispe, C.; Crease, T. (2003-05-01). "Phylogenetic relationships between parthenogens and their sexual relatives: the possible routes to parthenogenesis in animals". Biological Journal of the Linnean Society 79 (1): 151–163. ISSN 1095-8312. doi:10.1046/j.1095-8312.2003.00175.x.
- ↑ Stelzer, C.-P. (2008-01-01). "Obligate asex in a rotifer and the role of sexual signals". Journal of Evolutionary Biology 21 (1): 287–293. ISSN 1420-9101. doi:10.1111/j.1420-9101.2007.01437.x.
- ↑ Stelzer, Claus-Peter; Schmidt, Johanna; Wiedlroither, Anneliese; Riss, Simone (2010-09-20). "Loss of Sexual Reproduction and Dwarfing in a Small Metazoan". PLoS ONE 5 (9): e12854. PMC 2942836. PMID 20862222. doi:10.1371/journal.pone.0012854.
- ↑ Crowe J (1971). "Anhydrobiosis: an unsolved problem". American Naturalist 105: 563–573. JSTOR 2459752. doi:10.1086/282745.
- ↑ 21,0 21,1 Guidetti R (2002). "Long-term anhydrobiotic survival in semi-terrestrial micrometazoans". Journal of zoology 257: 181–187. doi:10.1017/s095283690200078x.
- ↑ Ricci, Claudia; Caprioli, Manuela; Fontaneto, Diego (2007-08-16). "Stress and fitness in parthenogens: is dormancy a key feature for bdelloid rotifers?". BMC Evolutionary Biology 7 (Suppl 2): S9. ISSN 1471-2148. PMC 1963474. PMID 17767737. doi:10.1186/1471-2148-7-S2-S9. Arquivado dende o orixinal o 15 de febreiro de 2008. Consultado o 09 de xuño de 2016.
- ↑ Wilson, Christopher G.; Sherman, Paul W. (2010-01-29). "Anciently Asexual Bdelloid Rotifers Escape Lethal Fungal Parasites by Drying Up and Blowing Away". Science 327 (5965): 574–576. ISSN 0036-8075. PMID 20110504. doi:10.1126/science.1179252.
- ↑ Wilson, Christopher G.; Sherman, Paul W. (2013-08-22). "Spatial and temporal escape from fungal parasitism in natural communities of anciently asexual bdelloid rotifers". Proceedings B 280 (1765): 20131255. PMC 3712457. PMID 23825214. doi:10.1098/rspb.2013.1255.
- ↑ Boschetti C (2011). "Foreign genes and novel hydrophilic protein genes participate in the desiccation response of the bdelloid rotifer Adineta ricciae". The Journal of Experimental Biology 214 (1): 59–68. doi:10.1242/jeb.050328.
- ↑ Gladyshev E (2008). "Extreme resistance of bdelloid rotifers to ionizing radiation" (PDF). Proceedings of the National Academy of Sciences 105 (13): 5139–5144. doi:10.1073/pnas.0800966105.
- ↑ 27,0 27,1 Hespeels B, Knapen M, Hanot-Mambres D, Heuskin AC, Pineux F, LUCAS S, Koszul R, Van Doninck K (July 2014). "Gateway to genetic exchange? DNA double-strand breaks in the bdelloid rotifer Adineta vaga submitted to desiccation". J. Evol. Biol. 27 (7): 1334–45. PMID 25105197. doi:10.1111/jeb.12326.
- ↑ Mark Welch DB, Mark Welch JL, Meselson M (April 2008). "Evidence for degenerate tetraploidy in bdelloid rotifers". Proc. Natl. Acad. Sci. U.S.A. 105 (13): 5145–9. PMC 2278229. PMID 18362354. doi:10.1073/pnas.0800972105.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Bdeloideos |
- Introdución aos rotíferos
- Rotifer World Catalog, por Jersabek C.D. & Leitner M.F. Arquivado 25 de outubro de 2021 en Wayback Machine.
- The Weird Sisters Arquivado 01 de outubro de 2015 en Wayback Machine.
- Bdelloids: No sex for over 40 million years Arquivado 23 de abril de 2008 en Wayback Machine.
- An Evolutionary Scandal, no Harvard Magazine
- Who Needs Sex (or Males) Anyway? Arquivado 11 de febreiro de 2009 en Wayback Machine.


