Beta-amiloide
- Ver tamén Placa senil, Amiloide e Proteína precursora amiloide.
| Beta-amiloide | |||||||||
|---|---|---|---|---|---|---|---|---|---|
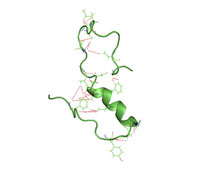 Estrutura parcialmente pregada do beta-amiloide(1 40) en ambiente acuoso (pdb 2lfm)[1] | |||||||||
| Identificadores | |||||||||
| Símbolo | APP | ||||||||
| Pfam | PF03494 | ||||||||
| InterPro | IPR013803 | ||||||||
| SCOPe | 2lfm / SUPFAM | ||||||||
| TCDB | 1.C.50 | ||||||||
| OPM superfamily | 369 | ||||||||
| OPM protein | 2y3k | ||||||||
| |||||||||
| |
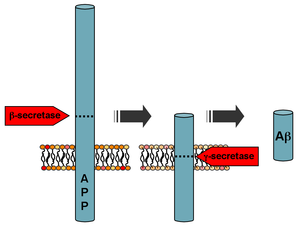
| Procesamento da proteína precursora amiloide | |
proteína precursora do amiloide-beta (A4) (peptidase nexina-II, enfermidade de Alzheimer)
| |
| Identificadores | |
| Símbolo | APP |
| Símbolos alt. | AD1 |
| Entrez | 351 |
| HUGO | 620 |
| OMIM | |
| RefSeq | NM_000484 |
| UniProt | P05067 |
| Outros datos | |
| Locus | Cr. 21 q21.2 |
Beta-amiloide ou amiloide-beta (Aβ ou Abeta) é o termo con que se designan os péptidos de 36 a 43 aminoácidos que están implicados de forma fundamental na enfermidade de Alzheimer como principais compoñentes das placas amiloides que se encontran nos cerebros dos pacientes de dita doenza. Os péptidos orixínanse a partir da proteína precursora amiloide (APP), a cal é cortada por certos encimas dando lugar aos péptidos Aβ. As moléculas de Aβ poden agregarse para formar oligómeros flexibles solubles, dos que existen varias formas. Crese que certos oligómeros incorrectamente pregados (coñecidos como "sementes") poden inducir a outras moléculas de Aβ a adoptaren a forma oligomérica incorrecta, orixinando unha reacción en cadea similar á producida por unha infección de prións. As sementes ou as placas amiloides resultantes son tóxicas para as células nerviosas. Outra proteína implicada na enfermidade de Alzheimer, a proteína tau, tamén forma este tipo de oligómeros incorrectamente pregados ao estilo dos prións (ver nobelo neurofibrilar), e hai algunhas probas de que o Aβ mal pregado pode inducir o pregamento incorrecto de tau.[2]
Un estudo recente suxeriu que a APP e o seu potencial amiloide ten orixes antigos, que se poden datar ao momento da aparición dos primeiros animais deuteróstomos.[3]
Actividade normal
[editar | editar a fonte]A función normal do Aβ non se coñece ben.[4] Aínda que algúns estudos animais mostraron que a ausencia de Aβ non produce ningunha perda de funcións fisiolóxicas,[5] descubríronse varias actividades potenciais do Aβ, entre as que están a activación de encimas quinases,[6][7] a protección contra o estrés oxidativo,[8][9] a regulación do transporte do colesterol,[10][11] funcionando como un factor de transcrición,[12][13] e actividades antimicrobianas (potencialmente asociadas con actividades inflamatorias do Aβ).[14]
O chamado sistema glinfático (non confundir con linfático) encárgase de limpar os refugallos metabólicos do cerebro dos mamíferos, e en especial os beta-amiloides.[15] A taxa de eliminación increméntase significativamente durante o sono.[16]
Asociación con enfermidades
[editar | editar a fonte]O Aβ é o principal compoñente das placas amiloides (depósitos extracelulares que se encontran no cerebro dos pacientes da enfermidade de Alzheimer). Placas similares aparecen nalgunhas variantes da demencia de corpos de Lewy e na miosite de corpos de inclusión (unha enfermidade muscular), pero o Aβ pode tamén formar agregados que cobren os vasos sanguíneos cerebrais na anxiopatía amiloide cerebral. As placas están compostas por un enguedello de agregados fibrilares regularmente ordenados chamados fibras amiloides,[17] que é un pregamento proteico que se dá tamén noutros péptidos como os prións asociados con enfermidades de pregamento incorrecto de proteínas. Investigacións recentes suxiren que as formas oligoméricas solubles do péptido poden ser os axentes causantes do desenvolvemento da enfermidade de Alzheimer.[18][19] Crese en xeral que os oligómeros Aβ son os máis tóxicos.[20] Varios estudos xenéticos, de bioloxía celular, bioquímica e animais apoian o concepto de que o Aβ ten un papel central no desenvolvemento da patoloxía da enfermidade de Alzheimer.[21][22]
O Aβ cerebral está elevado en pacientes con enfermidade de Alzheimer esporádica. O Aβ é o principal constituínte do amiloide do parénquima cerebral e do amiloide vascular; contribúe a lesións cerebrovasculares e é neurotóxico.[21][22][23][24] Aínda non se sabe como se acumula o Aβ no sistema nervioso central e inicia despois a enfermidade nas células. Algúns investigadores atoparon que os oligómeros Aβ inducen algúns dos síntomas da enfermidade de Alzheimer ao competiren coa insulina para unirse ao receptor da insulina, o cal altera o metabolismo da glicosa no cerebro.[25] Fixéronse esforzos significativos no estudo dos mecanismos responsables da produción do Aβ, incluíndo o estudo dos encimas proteolíticos alfa- e β-secretases, que xeran a forma Aβ a partir da súa proteína precursora a APP (proteína precursora amiloide).[26][27][28][29] O Aβ circula no plasma, líquido cefalorraquídeo e fluído intersticial cerebral principalmente como Aβ40 soluble[21][30] As placas senís conteñen tanto Aβ40 coma Aβ42,[31] mentres que o amiloide vascular está feito predominantemente do Aβ40, o máis curto. En ambos os tipos de lesións atopáronse varias secuencias do Aβ.[32][33][34] A xeración do Aβ no sistema nerviosos central pode ter lugar nas membranas dos axóns neuronais despois do transporte axonal mediado por APP de β-secretase e presenilina-1.[35]
Os incrementos nos niveis totais de Aβ ou as concentracións relativas de Aβ40 e Aβ42 (o primeiro está máis concentrado nas placas cerebrovasculares e o último nas placas neuríticas)[36] foron implicados na patoxénese da enfermidadede de Alzheimer esporádica e na familiar. Debido á súa natureza máis hidrofóbica, o Aβ42 é a forma máis amiloidoxénica do péptido. Porén, sábese que a secuencia central KLVFFAE forma amiloides por si mesma, e probablemente forma a parte central das fibrilas.
A "hipótese amiloide", que di que as placas son responsables da patoloxía da enfermidade de Alzheimer, é aceptada pola maioría dos investigadores, pero aínda non está establecida concluintemente. Unha hipótese alternativa é que son os oligómeros amiloides e non as placas as responsables da doenza.[20][37] Os ratos que foron modificados por enxeñaría xenética para expresar oligómeros pero non placas (APPE693Q) desenvolven tamén a enfermidade. Ademais, os ratos que adicionalmente foron modificados para que convertan os oligómeros en placas (APPE693Q X PS1ΔE9), non están máis afectados que os ratos con só oligómeros.[38] Na doenza tamén se observan depósitos intracelulares de proteína tau, e poden tamén estar implicados, xa que teñen agregación de alfa-sinucleína.
Formación
[editar | editar a fonte]O Aβ fórmase despois dunha clivaxe (corte) secuencial encimático da proteína precursora amiloide (APP), que é unha glicoproteína transmembrana de función aínda non determinada. A APP pode ser clivada polos encimas proteolíticos α-, β- e γ-secretases; a proteína Aβ xérase pola acción sucesiva das β e γ secretases. A γ secretase, que orixina o extremo C-terminal do péptido Aβ, cliva no interior da rexión transmembrana da APP e pode xerar un número de isoformas con lonxitudes de entre 36 e 43 residuos de aminoácidos. As isoformas máis comúns son Aβ40 e Aβ42; a forma máis longa é producida pola clivaxe que ocorre no retículo endoplasmático, mentres que a forma máis curta é producida por clivaxe na rede trans-Golgi.[39] A forma Aβ40 é a máis común das dúas, pero a Aβ42 é a máis fibriloxénica e é asociada con estados de enfermidade. As mutacións na APP asociados con Alzhéimer de comezo temperán incrementan a produción relativa de Aβ42, e así suxeriuse que unha posible vía de terapias para o Alzhéimer sería a modulación da actividade das β e γ secretases para producir principalmente Aβ40.[40] O Aβ é destruído por varios encimas que degradan o amiloide como a neprilisina.[41]
Xenética
[editar | editar a fonte]Mutacións autosómicas dominantes na APP causan a enfermidade de Alzheimer familiar de comezo temperán hereditaria. Esta forma de enfermidade de Alzheimer supón non máis do 10% dos casos totais de Alzheimer, polo que a gran maioría dos casos de enfermidade de Alzheimer non están acompañados por ditas mutacións.[42] Porén, a enfermidade de Alzheimer familiar é probablemente o resultado dun procesamento proteolítico alterado.
O xene da proteína precursora amiloide está localizado no cromosoma 21 humano, e en consecuencia os pacientes con trisomía 21 (síndrome de Down) teñen unha incidencia moi alta da enfermidade de Alzheimer.
Estrutura e toxicidade
[editar | editar a fonte]Crese xeralmente que o amiloide beta é unha proteína non estruturada intrinsecamente, o que significa que en solución non adquire un pregamento terciario único senón que pode formar todo un conxunto de estruturas. Isto implica que non pode ser cristalizada e a maioría do coñecemento estrutural do amiloide beta obtense de resonancia magnética nuclear (RMN) e dinámica molecular. Os modelos iniciais derivados de RMN do polipéptido de 26 aminoácidos do amiloide beta (Aβ 10-35) mostraban unha estrutura colapsada de enrolamento aleatorio desprovista dunha estrutura secundaria significativa,[43] porén, a estrutura RMN máis recente (ano 2012) de Aβ 1-40 presenta unhas estruturas secundaria e terciaria significativas.[1] Os estudos de dinámica molecular de intercambio de réplica (replica exchange) suxeriron que o amiloide beta pode en realidade formar moitos estados estruturais discretos distintos;[44] estudos máis recentes identificaron múltiples clusters conformacionais discretos por análise estatística.[45] Por simulacións guiadas por RMN, o Aβ 1-40 e o Aβ 1-42 tamén parecen formar estados conformacionais moi diferentes,[46] e o C-terminal do Aβ 1-42 está máis estruturado que o do fragmento 1-40.
A información estrutural no estado oligomérico do amiloide beta era aínda escasa en 2010. En condicións de alta concentración salina e alta temperatura illáronse oligómeros con forma de disco pentaméricos sen estrutura beta.[47] Pero os oligómeros solubles preparados en presenza de deterxentes parecen ter un contido substancial de folla beta de tipo paralelo e antiparalelo mesturado, diferente das fibrilas.[48] Polo contrario, os estudos computacionais suxiren un motivo antiparalelo de beta-xiro-beta para os oligómeros incrustados na membrana.[49]
O mecanismo polo cal o amiloide beta pode danar e matar as neuronas é a xeración de especies reactivas do oxíxeno durante o seu proceso de autoagregación. Cando isto ocorre na membrana das neuronas orixínase unha peroxidación de lípidos e a xeración dun aldehido tóxico chamado 4-hidroxinonenal, o cal, á súa vez, altera a función das ATPases iónicas, transportadores de glicosa e transportadores de glutamato. Como resultado o amiloide beta promove a despolarización da membrana sináptica, un fluxo excesivo de calcio e a alteración mitocondrial.[50]
Estratexias de intervención
[editar | editar a fonte]Os investigadores da enfermidade de Alzheimer identificaron cinco estratexias que poderían utilizarse contra os amiloides, que son:[51]
- inhibidores da β-secretase. Funcionan bloqueando a primeira clivaxe da APP fóra da célula.
- Inhibidores da γ-secretase (por exemplo, o semagacestat). Funcionan bloqueando a segunda clivaxe da APP na membrana plasmática e poderían parar a formación subseguinte de Aβ e os seus fragmentos tóxicos.
- Axentes que diminúen selectivamente o Aβ42 (como o tarenflurbil). Estes modulan a γ-secretase para reducir a produción de Aβ42 en favor doutras versións do Aβ (máis curtas).
As β- e γ-secretases son responsables da xeración de Aβ a partir da liberación do dominio intracelular da APP, o que significa que os compostos que poden inhibir parcialmente a actividade das β- e γ-secretases son moi procurados polos investigadores. Para iniciar a inhibición parcial da β- e γ-secretases, necesítase un composto que poida bloquear o sitio activo das aspartil proteases e que poida atravesar a barreira hematoencefálica. Ata agora, evitárase facer probas en humanos polo perigo de que puidesen interferir coa vía de sinalización das proteínas Notch e outros receptores da superficie celular.
- Inmunoterapia. Estimula o sistema inmunitario do hóspede para que recoñeza e ataque ao Aβ, ou proporciona anticorpos que impiden a deposición de placa ou potencian a eliminación dos oligómeros Aβ. A oligomerización é un proceso químico que converte as moléculas individuais en cadeas formadas por un número finito delas. A prevención da oligomerización dos Aβ foi exemplificada pola inmunización Aβ activa ou pasiva. Neste proceso os anticorpos de Aβ utilízanse para facer diminuír os niveis de placas cerebrais. Isto conséguese promovendo a limpeza microglial e/ou redistribuíndo o péptido do cerebro á circulación sistémica. Unha destas vacinas contra o beta-amiloide que está actualmente en ensaio clínico é a CAD106.[52] A inmunización con Aβ1-42 sintético é beneficiosa en ratos e mostra pouca toxicidade; porén, nos ensaios humanos obtivéronse significativas diferenzas, ata o punto que esta inmunización non é aínda efectiva en humanos e require unha maior investigación. Certos descubrimentos específicos indican que a proteína SDPM1 de 20 aminoácidos se une a formas tetrámeras dos amiloides Aβ(1-40) e Aβ(1-42) e bloquea a subseguinte agregación do amiloide Aβ. É importante salientar que este estudo se fixo en ratos e que aínda que impide un desenvolvemento posterior de neuropatoloxías, non orixina unha mellora no rendemento cognitivo. Finalmente, a inmunización Aβ42 orixinou a eliminación de placas amiloides en pacientes da enfermidade de Alzheimer, pero non impide a neurodexeneración progresiva.[53]
- Axentes antiagregación[54] como a apomorfina. Estes impiden que os fragmentos Aβ se agreguen ou se eliminen os agregados unha vez que se forman.[55] Os estudos que comparan os Aβ42 sintéticos e recombinantes en ensaios que miden a velocidade de fibrilación, homoxeneidade das fibrilas, e toxicidade celular indicaron que o Aβ42 recombinante tiña unha velocidade de fibrilación máis rápida e maior toxicidade que o péptido amiloide beta 1-42 sintético.[56] Esta observación combinada coa irreproducibilidade de certos estudos experimentais co Aβ42 suxeriu que esta é a causa da falta de progresos na investigación do Alzheimer.[57] En consecuencia, fixéronse renovados esforzos para fabricar Aβ42 e outros péptidos amiloides nunha pureza que non tiña precedentes (>99%).[58]
Hai algunhas indicacións de que a suplementación coa hormona melatonina pode ser efectiva contra o amiloide. A melatonina interacciona co amiloide beta e inhibe a súa agregación.[59][60][61] Esta actividade antiagregatoria ten lugar só por medio dunha interacción con dímeros dun péptido amiloide beta soluble. A melatonina non reverte a formación de fibrilas ou de oligómeros de amiloide beta unha vez formados. Isto está apoiado por experimentos en ratos transxénicos, que suxiren que a melatonina ten o potencial de impedir a a deposición amiloide se é administrada cedo na vida, pero pode non ser eficaz para reverter a deposición amiloide ou tratar a enfermidade de Alzheimer.
Esta conexión coa melatonina, a cal regula o sono, está reforzada polas investigacións recentes que indican que a hormona orexina, que induce a vixilia, inflúe no amiloide beta (véxase máis abaixo).[62] É interesante indicar que os experimentos animais mostran que a melatonina pode tamén corrixir as elevacións leves dos niveis de colesterol, que son tamén un factor de risco tenmperán para a formación de amiloides.
O canabinoide HU-210 prevén a inflamación promovida polo amiloide beta.[63] Os endocanabinoides anandamida e noladina tamén son neuroprotectores contra o amiloide beta in vitro.[64]
As dietas altas en colesterol tenden a incrementar a patoloxía Aβ en animais. A modulación da homeostase do colesterol deu resultados que indican que o uso crónico de fármacos que reducen o colesterol, como as estatinas, está asociado cunha menor incidencia de enfermidade de Alzheimer. En ratos xeneticamente modificados na APP, os fármacos redutores do colesterol reducen a patoloxía no seu conxunto. Aínda que o mecanismo está mal comprendido parece que os fármacos que reducen o colesterol teñen un efecto directo sobre o procesamento da APP.[65]
A terapia de quelación, que está implicada na eliminación de metais pesados do corpo, tamén é beneficiosa para rebaixar os niveis de placas amiloides. Isto débese a que a agregación Aβ depende en certa medida dos ións metálicos cobre e cinc. O cinc que se encontra nas vesículas sinápticas, que está baixo o control do transportador de cinc ZnT3, xoga un papel principal na formación de Aβ. A expresión de ZnT3 é significativamente máis baixa nos pacientes de Alzheimer comparados cos pacientes sans. Os ratos sen ZnT3 teñen un nivel de formación de placas moito menor. Apoia esta idea o feito de que a deposición Aβ está impedida en ratos transxénicos para APP tratados co antibiótico clioquinol, que é un coñecido quelador de cobre/cinc.[65]
A terapia farmacolóxica é outro posible enfoque do trratamento. O memantine é un fármaco para o Alzheimer que recibiu unha ampla aprobación. É un bloqueador non competitivo do canal de N-metil-D-aspartato (NMDA). Ao unirse ao receptor de NMDA cunha afinidade máis alta que os ións Mg2+, o memantine pode inhibir o fluxo prolongado de ións Ca2+, particularmente desde receptores extrasinápticos, o cal forma a base da excitotoxicidade neuronal. É unha opción para o tratamento de pacientes con enfermidade de Alzheimer de moderada a grave (pero con efectos modestos). O estudo mostrou que 20 mg/día melloraban a cognición, capacidade funcional e síntomas de comportamento na poboación de pacientes.[66]
Outro fármaco que se está a investigar actualmente é o victoza, o cal se usa normalmente como fármaco para a diabetes. O tratamento con victoza produciu beneficios cognitivos que incluían unha mellora do recoñecemento espacial e de obxectos. Adicionalmente, o victoza potencia a indución e mantemento da potenciación a longo prazo (LTP) e a facilitación de pulso par (paired-pulse facilitation, PPF) tanto en ratos APP/PS1 coma non alterados xeneticamente. Outros beneficios histolóxicos son unha redución da resposta inflamatoria e un incremento no número de neuronas novas no xiro dentado do encéfalo. O nivel de β-amiloide estaba tamén significativamente reducido.[67]
Ritmo circadiano do amiloide beta
[editar | editar a fonte]Un informe de 2009 demostrou que a produción de amiloide beta segue un ritmo circadiano, e aumenta cando un animal (rato) ou persoa está esperto e diminúe durante o sono.[62] A neuroproteína que promove a vixilia orexina é necesaria para os ritmos circadianos da produción de amiloide beta.[62] O informe suxería que os períodos excesivos de vixilia (é dicir, cando hai un débito de sono) poderían causar unha acumulación crónica de amiloide beta, o cal podería hipoteticamente orixinar a enfermidade de Alzheimer.[62] Isto é concordante con descubrimentos recentes que indican que a privación crónica do sono está asociada coa enfermidade de Alzheimer de comezo temperán.[62]
A melatonina está tamén implicada no mantemento dos ritmos circadianos. É salientable que a melatonina foi conectada co fenómeno "da posta dos sol", no cal os pacientes da enfermidade de Alzheimer que teñen placas amiloides no hipotálamo presentan unha exacerbación dos síntomas da enfermidade de Alzheimer nas horas finais do día.[68] Este fenómeno "da posta do sol" podería estar directa ou indirectamente relacionado co incremento continuo do amiloide beta ao longo do día que se descubriu recentemente.
Medición do amiloide beta
[editar | editar a fonte]
Hai moitos xeitos de medir a cantidade de amiloide beta. Pode medirse semicuantitativamente con inmunotinguidura, o cal tamén permite determinar a súa localización. O amiloide beta pode ser principalmente vascular, como na anxiopatía amiloide cerebral, ou aparecer en placas senís e en vasos sanguíneos.
Un método moi sensible é a ELISA, a cal é un ensaio inmunosorbente que utiliza un par de anticorpos que recoñecen o amiloide beta.[69][70]
Certos compostos utilizados para obter imaxes, principalmente o composto de Pittsburgh B, (6-OH-BTA-1, unha tioflavina), pode unirse selectivamente ao amiloide beta in vitro e in vivo. Esta técnica, combinada con imaxes de tomografía de emisión de positróns (PET), foi utilizada para obter imaxes de áreas de depósitos de placas en pacientes de Alzheimer.
O micorscopio de forza atómica, que pode visualizar superficies moleculares a nanoescala, pode utilizarse para determinar o estado de agregación do amiloide beta in vitro.[71]
A interferometría de polarización dual é unha técnica óptica que pode medir os estados temperáns de agregación e inhibición medindo o tamaño molecular e densidades a medida que as fibrilas se alongan.[72][73] Estes procesos de agregación poden tamén ser estudados en constructos de bicapa lipídica.[74]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Vivekanandan S, Brender JR, Lee SY, Ramamoorthy A (July 2011). "A partially folded structure of amyloid-beta(1-40) in an aqueous environment". Biochem. Biophys. Res. Commun. 411 (2): 312–6. PMC 3148408. PMID 21726530. doi:10.1016/j.bbrc.2011.06.133.
- ↑ Nussbaum, J. M.; Seward, M. E.; Bloom, G. S. (2013). "Alzheimer disease: A tale of two prions". Prion 7 (1): 14–9. doi:10.4161/pri.22118. PMC 3609044. PMID 22965142.
- ↑ Sarkar IN, Tharp G (April 2013). "Origins of amyloid-beta.". BMC Genomics 14 (1): 290. PMID 23627794. doi:10.1186/1471-2164-14-290.
- ↑ Hiltunen M, van Groen T, Jolkkonen J (2009). "Functional roles of amyloid-beta protein precursor and amyloid-beta peptides: evidence from experimental studies". J. Alzheimers Dis. 18 (2): 401–12. PMID 19584429. doi:10.3233/JAD-2009-1154.
- ↑ Luo Y, Bolon B, Damore MA, Fitzpatrick D, Liu H, Zhang J, Yan Q, Vassar R, Citron M (October 2003). "BACE1 (beta-secretase) knockout mice do not acquire compensatory gene expression changes or develop neural lesions over time". Neurobiol. Dis. 14 (1): 81–8. PMID 13678669. doi:10.1016/S0969-9961(03)00104-9.
- ↑ Bogoyevitch MA, Boehm I, Oakley A, Ketterman AJ, Barr RK (March 2004). "Targeting the JNK MAPK cascade for inhibition: basic science and therapeutic potential". Biochim. Biophys. Acta 1697 (1–2): 89–101. PMID 15023353. doi:10.1016/j.bbapap.2003.11.016.
- ↑ Tabaton M, Zhu X, Perry G, Smith MA, Giliberto L (January 2010). "Signaling Effect of Amyloid-β42 on the Processing of AβPP". Exp. Neurol. 221 (1): 18–25. PMC 2812589. PMID 19747481. doi:10.1016/j.expneurol.2009.09.002.
- ↑ Zou K, Gong JS, Yanagisawa K, Michikawa M (June 2002). "A novel function of monomeric amyloid beta-protein serving as an antioxidant molecule against metal-induced oxidative damage". J. Neurosci. 22 (12): 4833–41. PMID 12077180.
- ↑ Baruch-Suchodolsky R, Fischer B (May 2009). "Abeta40, either soluble or aggregated, is a remarkably potent antioxidant in cell-free oxidative systems". Biochemistry 48 (20): 4354–70. PMID 19320465. doi:10.1021/bi802361k.
- ↑ Yao ZX, Papadopoulos V (October 2002). "Function of beta-amyloid in cholesterol transport: a lead to neurotoxicity". FASEB J. 16 (12): 1677–9. PMID 12206998. doi:10.1096/fj.02-0285fje.
- ↑ Igbavboa U, Sun GY, Weisman GA, He Y, Wood WG (August 2009). "Amyloid β-Protein Stimulates Trafficking of Cholesterol and Caveolin-1 from the Plasma Membrane to the Golgi Complex in Mouse Primary Astrocytes". Neuroscience 162 (2): 328–38. PMC 3083247. PMID 19401218. doi:10.1016/j.neuroscience.2009.04.049.
- ↑ Maloney B, Lahiri DK (June 2011). "The Alzheimer's amyloid β-peptide (Aβ) binds a specific DNA Aβ-interacting domain (AβID) in the APP, BACE1, and APOE promoters in a sequence-specific manner: Characterizing a new regulatory motif". Gene 488 (1–2): 1–12. PMC 3381326. PMID 21699964. doi:10.1016/j.gene.2011.06.004.
- ↑ Bailey JA, Maloney B, Ge YW, Lahiri DK (June 2011). "Functional activity of the novel Alzheimer's amyloid β-peptide interacting domain (AβID) in the APP and BACE1 promoter sequences and implications in activating apoptotic genes and in amyloidogenesis". Gene 488 (1–2): 13–22. PMC 3372404. PMID 21708232. doi:10.1016/j.gene.2011.06.017.
- ↑ Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD (2010). Bush, Ashley I., ed. "The Alzheimer's Disease-Associated Amyloid β-Protein Is an Antimicrobial Peptide". PLoS ONE 5 (3): e9505. Bibcode:2010PLoSO...5.9505S. PMC 2831066. PMID 20209079. doi:10.1371/journal.pone.0009505.
- ↑ Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, Benveniste H, Vates GE, Deane R, Goldman SA, Nagelhus EA, Nedergaard M (August 2012). "A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β". Sci Transl Med 4 (147): 147ra111. PMC 3551275. PMID 22896675. doi:10.1126/scitranslmed.3003748.
- ↑ Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O’Donne J, Christensen DJ, Nicholson C, Iliff JJ, Takano T, Deane R, Nedergaard M (2013). "Sleep Drives Metabolite Clearance from the Adult Brain". Science 342 (6156): 373–377. doi:10.1126/science.1241224.
- ↑ Parker MH, Reitz AB (2000). "Assembly of β-Amyloid Aggregates at the Molecular Level". Chemtracts-Organic Chemistry 13 (1): 51–56.
- ↑ Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I, Brett FM, Farrell MA, Rowan MJ, Lemere CA, Regan CM, Walsh DM, Sabatini BL, Selkoe DJ (August 2008). "Amyloid β-Protein Dimers Isolated Directly from Alzheimer Brains Impair Synaptic Plasticity and Memory". Nat. Med. 14 (8): 837–42. PMC 2772133. PMID 18568035. doi:10.1038/nm1782. Resumo divulgativo – Fox News.
- ↑ Prelli F, Castaño E, Glenner GG, Frangione B (August 1988). "Differences between vascular and plaque core amyloid in Alzheimer's disease". J. Neurochem. 51 (2): 648–51. PMID 3292706. doi:10.1111/j.1471-4159.1988.tb01087.x.
- ↑ 20,0 20,1 Zhao LN, Long H, Mu Y, Chew LY (2012). "The Toxicity of Amyloid β Oligomers". Int J Mol Sci 13 (6): 7303–27. PMC 3397527. PMID 22837695. doi:10.3390/ijms13067303.
- ↑ 21,0 21,1 21,2 Ghiso J, Frangione B (December 2002). "Amyloidosis and Alzheimer's disease". Adv. Drug Deliv. Rev. 54 (12): 1539–51. PMID 12453671. doi:10.1016/S0169-409X(02)00149-7.
- ↑ 22,0 22,1 Selkoe DJ (October 2001). "Clearing the brain's amyloid cobwebs". Neuron 32 (2): 177–80. PMID 11683988. doi:10.1016/S0896-6273(01)00475-5.
- ↑ Hardy J, Duff K, Hardy KG, Perez-Tur J, Hutton M (September 1998). "Genetic dissection of Alzheimer's disease and related dementias: amyloid and its relationship to tau". Nat. Neurosci. 1 (5): 355–8. PMID 10196523. doi:10.1038/1565.
- ↑ Roses AD (February 1998). "Alzheimer diseases: a model of gene mutations and susceptibility polymorphisms for complex psychiatric diseases". Am. J. Med. Genet. 81 (1): 49–57. PMID 9514588. doi:10.1002/(SICI)1096-8628(19980207)81:1<49::AID-AJMG10>3.0.CO;2-W.
- ↑ Xie L, Helmerhorst E, Taddei K, Plewright B, Van Bronswijk W, Martins R (May 2002). "Alzheimer's beta-amyloid peptides compete for insulin binding to the insulin receptor" (PDF). J. Neurosci. 22 (10): RC221. PMID 12006603.
- ↑ Ray WJ, Yao M, Mumm J, Schroeter EH, Saftig P, Wolfe M, Selkoe DJ, Kopan R, Goate AM (December 1999). "Cell surface presenilin-1 participates in the gamma-secretase-like proteolysis of Notch". J. Biol. Chem. 274 (51): 36801–7. PMID 10593990. doi:10.1074/jbc.274.51.36801.
- ↑ Roberts SB (December 2002). "γ-secretase inhibitors and Alzheimer's disease". Adv. Drug Deliv. Rev. 54 (12): 1579–88. PMID 12453675. doi:10.1016/S0169-409X(02)00155-2.
- ↑ Vassar R, Bennett BD, Babu-Khan S, Kahn S, Mendiaz EA, Denis P, Teplow DB, Ross S, Amarante P, Loeloff R, Luo Y, Fisher S, Fuller J, Edenson S, Lile J, Jarosinski MA, Biere AL, Curran E, Burgess T, Louis JC, Collins F, Treanor J, Rogers G, Citron M (October 1999). "Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE". Science 286 (5440): 735–41. PMID 10531052. doi:10.1126/science.286.5440.735.
- ↑ Vassar R (December 2002). "Beta-secretase (BACE) as a drug target for Alzheimer's disease". Adv. Drug Deliv. Rev. 54 (12): 1589–602. PMID 12453676. doi:10.1016/S0169-409X(02)00157-6.
- ↑ Zlokovic BV, Frangione B (2003). Transport-clearance hypothesis for Alzheimer’s disease and potential therapeutic implications. Landes Bioscience. pp. 114–122.
- ↑ Masters CL, Simms G, Weinman NA, Multhaup G, McDonald BL, Beyreuther K (June 1985). "Amyloid plaque core protein in Alzheimer disease and Down syndrome". Proc. Natl. Acad. Sci. U.S.A. 82 (12): 4245–9. Bibcode:1985PNAS...82.4245M. PMC 397973. PMID 3159021. doi:10.1073/pnas.82.12.4245.
- ↑ Castaño EM, Prelli F, Soto C, Beavis R, Matsubara E, Shoji M, Frangione B (December 1996). "The length of amyloid-beta in hereditary cerebral hemorrhage with amyloidosis, Dutch type. Implications for the role of amyloid-beta 1-42 in Alzheimer's disease". J. Biol. Chem. 271 (50): 32185–91. PMID 8943274. doi:10.1074/jbc.271.50.32185.
- ↑ Roher AE, Lowenson JD, Clarke S, Woods AS, Cotter RJ, Gowing E, Ball MJ (November 1993). "beta-Amyloid-(1-42) is a major component of cerebrovascular amyloid deposits: implications for the pathology of Alzheimer disease". Proc. Natl. Acad. Sci. U.S.A. 90 (22): 10836–40. Bibcode:1993PNAS...9010836R. PMC 47873. PMID 8248178. doi:10.1073/pnas.90.22.10836.
- ↑ Shinkai Y, Yoshimura M, Ito Y, Odaka A, Suzuki N, Yanagisawa K, Ihara Y (September 1995). "Amyloid beta-proteins 1-40 and 1-42(43) in the soluble fraction of extra- and intracranial blood vessels". Ann. Neurol. 38 (3): 421–8. PMID 7668828. doi:10.1002/ana.410380312.
- ↑ Kamal A, Almenar-Queralt A, LeBlanc JF, Roberts EA, Goldstein LS (December 2001). "Kinesin-mediated axonal transport of a membrane compartment containing beta-secretase and presenilin-1 requires APP". Nature 414 (6864): 643–8. PMID 11740561. doi:10.1038/414643a.
- ↑ Lue LF, Kuo YM, Roher AE, Brachova L, Shen Y, Sue L, Beach T, Kurth JH, Rydel RE, Rogers J (September 1999). "Soluble Amyloid β Peptide Concentration as a Predictor of Synaptic Change in Alzheimer's Disease". Am. J. Pathol. 155 (3): 853–62. PMC 1866907. PMID 10487842. doi:10.1016/S0002-9440(10)65184-X. Arquivado dende o orixinal o 15 de setembro de 2003. Consultado o 12 de marzo de 2014.
- ↑ Kayed R, Head E, Thompson JL, McIntire TM, Milton SC, Cotman CW, Glabe CG (April 2003). "Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis". Science 300 (5618): 486–9. Bibcode:2003Sci...300..486K. PMID 12702875. doi:10.1126/science.1079469.
- ↑ Gandy S, Simon AJ, Steele JW, Lublin AL, Lah JJ, Walker LC, Levey AI, Krafft GA, Levy EF, Checler F, Glabe C, Bilker W, Abel T, Schmeidler J, Ehrlich ME (2010). "Days-to-criterion as an indicator of toxicity associated with human Alzheimer amyloid-β oligomers". Annals of Neurology 67 (6): 220–30. PMC 3094694. PMID 20641005. doi:10.1002/ana.22052. Resumo divulgativo – Drug Discovery and Development.
- ↑ Hartmann T, Bieger SC, Brühl B, Tienari PJ, Ida N, Allsop D, Roberts GW, Masters CL, Dotti CG, Unsicker K, Beyreuther K (September 1997). "Distinct sites of intracellular production for Alzheimer's disease A beta40/42 amyloid peptides". Nat. Med. 3 (9): 1016–20. PMID 9288729. doi:10.1038/nm0997-1016.
- ↑ Yin YI, Bassit B, Zhu L, Yang X, Wang C, Li YM (August 2007). "γ-Secretase Substrate Concentration Modulates the Aβ42/Aβ40 Ratio: Implications for Alzheimer's disease". J. Biol. Chem. 282 (32): 23639–44. PMID 17556361. doi:10.1074/jbc.M704601200.
- ↑ Nalivaeva NN, Belyaev ND, Zhuravin IA, Turner AJ (2012). "The Alzheimer's amyloid-degrading peptidase, neprilysin: can we control it?". Int J Alzheimers Dis 2012: 383796. PMC 3412116. PMID 22900228. doi:10.1155/2012/383796.
- ↑ Maslow K (March 2008). "2008 Alzheimer's disease facts and figures". Alzheimers Dement 4 (2): 110–33. PMID 18631956. doi:10.1016/j.jalz.2008.02.005.
- ↑ Zhang S, Iwata K, Lachenmann MJ, Peng JW, Li S, Stimson ER, Lu Y, Felix AM, Maggio JE, Lee JP (June 2000). "The Alzheimer's peptide a beta adopts a collapsed coil structure in water". J. Struct. Biol. 130 (2-3): 130–41. PMID 10940221. doi:10.1006/jsbi.2000.4288.
- ↑ Yang M, Teplow DB (December 2008). "Amyloid beta-protein monomer folding: free-energy surfaces reveal alloform-specific differences". J. Mol. Biol. 384 (2): 450–64. PMC 2673916. PMID 18835397. doi:10.1016/j.jmb.2008.09.039.
- ↑ Sgourakis NG, Merced-Serrano M, Boutsidis C, Drineas P, Du Z, Wang C, Garcia AE (January 2011). "Atomic-level characterization of the ensemble of the Aβ(1-42) monomer in water using unbiased molecular dynamics simulations and spectral algorithms". J. Mol. Biol. 405 (2): 570–83. PMC 3060569. PMID 21056574. doi:10.1016/j.jmb.2010.10.015.
- ↑ Sgourakis NG, Yan Y, McCallum SA, Wang C, Garcia AE (May 2007). "The Alzheimer's peptides Abeta40 and 42 adopt distinct conformations in water: a combined MD / NMR study". J. Mol. Biol. 368 (5): 1448–57. PMC 1978067. PMID 17397862. doi:10.1016/j.jmb.2007.02.093.
- ↑ Ahmed M, Davis J, Aucoin D, Sato T, Ahuja S, Aimoto S, Elliott JI, Van Nostrand WE, Smith SO (May 2010). "Structural conversion of neurotoxic amyloid-beta(1-42) oligomers to fibrils". Nat. Struct. Mol. Biol. 17 (5): 561–7. PMC 2922021. PMID 20383142. doi:10.1038/nsmb.1799.
- ↑ Yu L, Edalji R, Harlan JE, Holzman TF, Lopez AP, Labkovsky B, Hillen H, Barghorn S, Ebert U, Richardson PL, Miesbauer L, Solomon L, Bartley D, Walter K, Johnson RW, Hajduk PJ, Olejniczak ET (March 2009). "Structural characterization of a soluble amyloid beta-peptide oligomer". Biochemistry 48 (9): 1870–7. PMID 19216516. doi:10.1021/bi802046n.
- ↑ Strodel B, Lee JW, Whittleston CS, Wales DJ (September 2010). "Transmembrane structures for Alzheimer's Aβ(1-42) oligomers". J. Am. Chem. Soc. 132 (38): 13300–12. PMID 20822103. doi:10.1021/ja103725c.
- ↑ Mattson MP (August 2004). "Pathways towards and away from Alzheimer's disease". Nature 430 (7000): 631–9. PMC 3091392. PMID 15295589. doi:10.1038/nature02621.
- ↑ Citron M (September 2004). "Strategies for disease modification in Alzheimer's disease". Nat. Rev. Neurosci. 5 (9): 677–85. PMID 15322526. doi:10.1038/nrn1495.
- ↑ Winblad B, Andreasen N, Minthon L, Floesser A, Imbert G, Dumortier T, Maguire RP, Blennow K, Lundmark J, Staufenbiel M, Orgogozo JM, Graf A (June 2012). "Safety, tolerability, and antibody response of active Aβ immunotherapy with CAD106 in patients with Alzheimer's disease: randomised, double-blind, placebo-controlled, first-in-human study". Lancet Neurol 11 (7): 597–604. PMID 22677258. doi:10.1016/S1474-4422(12)70140-0. Resumo divulgativo – Karolinska Institutet.
- ↑ Wang CM, Devries S, Camboni M, Glass M, Martin PT (September 2010). "Immunization with the SDPM1 peptide lowers amyloid plaque burden and improves cognitive function in the APPswePSEN1(A246E) transgenic mouse model of Alzheimer's disease". Neurobiol. Dis. 39 (3): 409–22. PMC 2913404. PMID 20493257. doi:10.1016/j.nbd.2010.05.013.
- ↑ Lashuel, H. A.; Hartley, D. M.; Balakhaneh, D.; Aggarwal A.; Teichberg S.; Callaway, D. J. E. (November 2002). "New class of inhibitors of amyloid-beta fibril formation. Implications for the mechanism of pathogenesis in Alzheimer's disease". J. Biol. Chem. 277 (45): 42881–90. PMID 12167652. doi:10.1074/jbc.M206593200.
- ↑ Parker MH, Chen R, Conway KA, Lee DH, Luo C, Boyd RE, Nortey SO, Ross TM, Scott MK, Reitz AB (November 2002). "Synthesis of (-)-5,8-dihydroxy-3R-methyl-2R-(dipropylamino)-1,2,3,4-tetrahydronaphthalene: an inhibitor of beta-amyloid(1-42) aggregation". Bioorg. Med. Chem. 10 (11): 3565–9. PMID 12213471. doi:10.1016/S0968-0896(02)00251-1.
- ↑ finder, v; glockshuber (2009). "The Recombinant Amyloid-β Peptide Aβ1–42 Aggregates Faster and Is More Neurotoxic than Synthetic Aβ1–42". journal of molecular biology 396: 9–18. doi:10.1016/j.jmb.2009.12.016.
- ↑ Editor. "State of Aggregation". Nature Neuroscience 14: 399. doi:10.1038/nn0411-399.
- ↑ "BioPure Amyloid Peptides".
- ↑ Pappolla M, Bozner P, Soto C, Shao H, Robakis NK, Zagorski M, Frangione B, Ghiso J (March 1998). "Inhibition of Alzheimer's beta fibrillogenesis by melatonin". J Biol Chem 273 (13): 7185–7188. PMID 9516407. doi:10.1074/jbc.273.13.7185.
- ↑ Lahiri DK, Chen DM, Lahiri P, Bondy S, Greig NH (November 2005). "Amyloid, cholinesterase, melatonin, and metals and their roles in aging and neurodegenerative diseases". Ann. N. Y. Acad. Sci. 1056: 430–49. Bibcode:2005NYASA1056..430L. PMID 16387707. doi:10.1196/annals.1352.008.
- ↑ Wang XC, Zhang YC, Chatterjie N, Grundke-Iqbal I, Iqbal K, Wang JZ (June 2008). "Effect of melatonin and melatonylvalpromide on beta-amyloid and neurofilaments in N2a cells". Neurochem. Res. 33 (6): 1138–44. PMID 18231852. doi:10.1007/s11064-007-9563-y.
- ↑ 62,0 62,1 62,2 62,3 62,4 Kang JE, Lim MM, Bateman RJ, Lee JJ, Smyth LP, Cirrito JR, Fujiki N, Nishino S, Holtzman DM (November 2009). "Amyloid-β Dynamics are Regulated by Orexin and the Sleep-Wake Cycle". Science 326 (5955): 1005–7. Bibcode:2009Sci...326.1005K. PMC 2789838. PMID 19779148. doi:10.1126/science.1180962. Resumo divulgativo – News-Medical.Net.
- ↑ Ramírez BG, Blázquez C, Gómez del Pulgar T, Guzmán M, de Ceballos ML (February 2005). "Prevention of Alzheimer's disease pathology by cannabinoids: neuroprotection mediated by blockade of microglial activation". J. Neurosci. 25 (8): 1904–13. PMID 15728830. doi:10.1523/JNEUROSCI.4540-04.2005.
- ↑ Milton NG (October 2002). "Anandamide and noladin ether prevent neurotoxicity of the human amyloid-beta peptide". Neurosci. Lett. 332 (2): 127–30. PMID 12384227. doi:10.1016/S0304-3940(02)00936-9.
- ↑ 65,0 65,1 Lee JY, Cole TB, Palmiter RD, Suh SW, Koh JY (May 2002). "Contribution by synaptic zinc to the gender-disparate plaque formation in human Swedish mutant APP transgenic mice". Proc. Natl. Acad. Sci. U.S.A. 99 (11): 7705–10. Bibcode:2002PNAS...99.7705L. PMC 124328. PMID 12032347. doi:10.1073/pnas.092034699.
- ↑ Schneider JS, Pioli EY, Jianzhong Y, Li Q, Bezard E (April 2013). "Effects of memantine and galantamine on cognitive performance in aged rhesus macaques". Neurobiol. Aging 34 (4): 1126–32. PMID 23158762. doi:10.1016/j.neurobiolaging.2012.10.020.
- ↑ McClean, P., Parthsarathy, V., Faivre, E., and Hölscher, C (November 2011). "The Diabetes Drug Liraglutide Prevents Degenerative Processes in a Mouse Model of Alzheimer's Disease". The Journal of Neuroscience 31 (17): 6587–6594. PMID 12213471. doi:10.1016/S0968-0896(02)00251-1.
- ↑ Volicer L, Harper D, Manning B, Goldstein R, Satlin A (2001). "Sundowning and circadian rhythms in Alzheimer's disease". Am J Psychiatry 158 (5): 704–11. PMID 11329390. doi:10.1176/appi.ajp.158.5.704.
- ↑ Schmidt SD, Nixon RA, Mathews PM (2012). "Tissue processing prior to analysis of Alzheimer's disease associated proteins and metabolites, including Aβ". Methods Mol. Biol. Methods in Molecular Biology 849: 493–506. ISBN 978-1-61779-550-3. PMID 22528111. doi:10.1007/978-1-61779-551-0_33.
- ↑ Schmidt SD, Mazzella MJ, Nixon RA, Mathews PM (2012). "Aβ measurement by enzyme-linked immunosorbent assay". Methods Mol. Biol. Methods in Molecular Biology 849: 507–527. ISBN 978-1-61779-550-3. PMID 22528112. doi:10.1007/978-1-61779-551-0_34.
- ↑ Stine WB, Dahlgren KN, Krafft GA, LaDu MJ (March 2003). "In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis". J. Biol. Chem. 278 (13): 11612–22. PMID 12499373. doi:10.1074/jbc.M210207200.
- ↑ Gengler S, Gault VA, Harriott P, Hölscher C (June 2007). "Impairments of hippocampal synaptic plasticity induced by aggregated beta-amyloid (25-35) are dependent on stimulation-protocol and genetic background". Exp Brain Res 179 (4): 621–30. PMID 17171334. doi:10.1007/s00221-006-0819-6.
- ↑ Rekas A, Jankova L, Thorn DC, Cappai R, Carver JA (December 2007). "Monitoring the prevention of amyloid fibril formation by alpha-crystallin. Temperature dependence and the nature of the aggregating species". FEBS J. 274 (24): 6290–304. PMID 18005258. doi:10.1111/j.1742-4658.2007.06144.x.
- ↑ Sanghera N, Swann MJ, Ronan G, Pinheiro TJ (October 2009). "Insight into early events in the aggregation of the prion protein on lipid membranes". Biochim. Biophys. Acta 1788 (10): 2245–51. PMID 19703409. doi:10.1016/j.bbamem.2009.08.005.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Martins IC, Kuperstein I, Wilkinson H, Maes E, Vanbrabant M, Jonckheere W, Van Gelder P, Hartmann D, D'Hooge R, De Strooper B, Schymkowitz J, Rousseau F (January 2008). "Lipids revert inert Aβ amyloid fibrils to neurotoxic protofibrils that affect learning in mice". EMBO J. 27 (1): 224–33. PMC 2206134. PMID 18059472. doi:10.1038/sj.emboj.7601953.
- Istrate AN, Tsvetkov PO, Mantsyzov AB, Kulikova AA, Kozin SA, Makarov AA, Polshakov VI (January 2012). "NMR solution structure of rat Aβ(1-16): toward understanding the mechanism of rats' resistance to Alzheimer's disease". Biophys J. 102 (1): 136–43. Bibcode:2012BpJ...102..136I. PMC 3250693. PMID 22225807. doi:10.1016/j.bpj.2011.11.4006.