Ciclofilina
| |
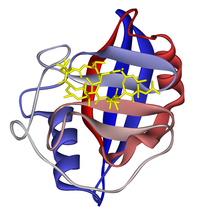
| Diagrama de fitas da ciclofilina A en complexo coa ciclosporina (en amarelo). PDB 1CWA. | |
Peptidilprolil isomerase A (ciclofilina A)
| |
| Identificadores | |
| Símbolo | PPIA |
| Entrez | 5478 |
| HUGO | 9253 |
| OMIM | |
| RefSeq | NM_203430 |
| UniProt | Q3KQW3 |
| Outros datos | |
| Número EC | 5.2.1.8 |
| Ciclofilina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estrutura de raios X da peptidil-prolil cis-trans isomerase a, ppia, rv0009, de Mycobacterium tuberculosis. | |||||||||
| Identificadores | |||||||||
| Símbolo | Pro_isomerase | ||||||||
| Pfam | PF00160 | ||||||||
| Pfam clan | CL0475 | ||||||||
| InterPro | IPR002130 | ||||||||
| PROSITE | PDOC00154 | ||||||||
| SCOPe | 1cyh / SUPFAM | ||||||||
| |||||||||
As cioclofilinas son unha familia de proteínas de vertebrados e outros organismos que se unen á ciclosporina, un inmunosupresor que xeralmente se usa para suprimir o rexeitamento despois dun transplante de órganos interno.[1] Estas proteínas teñen actividade de peptidil prolil isomerase, coa que catalizan a isomerización de enlaces peptídicos desde a forma trans á cis en residuos de prolina e facilitan o pregamento de proteínas.
A ciclofilina A é unha proteína citosólica e moi abondosa. A proteína pertence a unha familia de isocimas, na que se inclúen as ciclofilinas B e C, e as proteínas relacionadas coas ciclofilinas das células asasinas naturais.[2][3][4] Atopáronse importantes isoformas por toda a célula, incluíndo no retículo endoplasmático e algunhas mesmo son segregadas.
Dous membros ben coñecidos da familia son as ciclofilinas A e D.
Ciclofilina A (CypA)
[editar | editar a fonte]A ciclofilina A tamén chamada peptidilprolil isomerase A, que se encontra no citosol das células, ten unha estrutura en barril beta con dúas hélices alfa e unha folla beta. Outras ciclofilinas teñen estruturas similares á ciclofilina A. O complexo ciclosporina-ciclofilina A inhibe unha fosfatase dependente de calcio/calmodulina chamada calcineurina, cuxa inhibición se pensa que suprime o rexeitamento de órganos ao deter a produción das moléculas proinflamatorias TNF alfa e interleucina 2.
A ciclofilina A tamén é recrutada polas poliproteínas Gag durante a infección polo VIH-1, e a súa incorporación en novas partíclas víricas é esencial para a infectividade do VIH-1.[5]
Ciclofilina D
[editar | editar a fonte]A ciclofilina D, que está localizada na matriz da mitocondria, é só un compoñente modulador pero non estrutural do poro de transición de permeabilidade mitocondrial.[6][7] A abertura do poro aumenta a permeabilidade da membrana mitocondrial interna, e permite o fluxo de moléculas citosólicas ao interior da matriz mitocondrial, o que incrementa o volume da matriz, e altera a membrana mitocondrial externa. Como resultado, a mitocondria cae nunha desorde funcional, polo que a apertura do poro xoga un importante papel na morte celular. A ciclofilina D crese que regula a apertura do poro porque a ciclosporina A (CsA), que se une á CyP-D, inhibe a abertura do poro.
Porén, as mitocondrias procedentes de quistes do crustáceo Artemia franciscana, non presentan o poro de transición de permeabilidade mitocondrial.[8][9]
Exemplos
[editar | editar a fonte]Xenes humanos que codifican proteínas que conteñen dominios peptidil-prolil cis-trans isomerase de tipo ciclofilina son:
Notas
[editar | editar a fonte]- ↑ Stamnes MA, Rutherford SL, Zuker CS (September 1992). "Cyclophilins: a new family of proteins involved in intracellular folding". Trends Cell Biol. 2 (9): 272–6. PMID 14731520. doi:10.1016/0962-8924(92)90200-7.
- ↑ Trandinh CC, Pao GM, Saier MH (December 1992). "Structural and evolutionary relationships among the immunophilins: two ubiquitous families of peptidyl-prolyl cis-trans isomerases". FASEB J. 6 (15): 3410–20. PMID 1464374.
- ↑ Galat A (September 1993). "Peptidylproline cis-trans-isomerases: immunophilins". Eur. J. Biochem. 216 (3): 689–707. PMID 8404888. doi:10.1111/j.1432-1033.1993.tb18189.x.
- ↑ Hacker J, Fischer G (November 1993). "Immunophilins: structure-function relationship and possible role in microbial pathogenicity". Mol. Microbiol. 10 (3): 445–56. PMID 7526121. doi:10.1111/j.1365-2958.1993.tb00917.x.
- ↑ Thali M, Bukovsky A, Kondo E; et al. (24 November 1994). "Functional association of cyclophilin A with HIV-1 virions". Nature 372 (6504): 363–365. PMID 7969495. doi:10.1038/372363a0.
- ↑ Basso E, Fante L, Fowlkes J, Petronilli V, Forte MA, Bernardi P (May 2005). "Properties of the permeability transition pore in mitochondria devoid of Cyclophilin D". J. Biol. Chem. 280 (19): 18558–61. PMID 15792954. doi:10.1074/jbc.C500089200.
- ↑ Doczi J, Turiák L, Vajda S; et al. (February 2011). "Complex contribution of cyclophilin D to Ca2+-induced permeability transition in brain mitochondria, with relation to the bioenergetic state". J. Biol. Chem. 286 (8): 6345–53. PMC 3057831. PMID 21173147. doi:10.1074/jbc.M110.196600.
- ↑ Menze MA, Hutchinson K, Laborde SM, Hand SC (July 2005). "Mitochondrial permeability transition in the crustacean Artemia franciscana: absence of a calcium-regulated pore in the face of profound calcium storage". Am. J. Physiol. Regul. Integr. Comp. Physiol. 289 (1): R68–76. PMID 15718386. doi:10.1152/ajpregu.00844.2004.
- ↑ Konràd C, Kiss G, Töröcsik B; et al. (March 2011). "A distinct sequence in the adenine nucleotide translocase from Artemia franciscana embryos is associated with insensitivity to bongkrekate and atypical effects of adenine nucleotides on Ca2+ uptake and sequestration". FEBS J. 278 (5): 822–36. PMID 21205213. doi:10.1111/j.1742-4658.2010.08001.x.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Cyclophilins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.