Convertase de C3

| Convertase C3/C5 da vía do complemento clásica | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 3.4.21.43 | ||||||||
| Número CAS | 56626-15-4 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| |||||||||
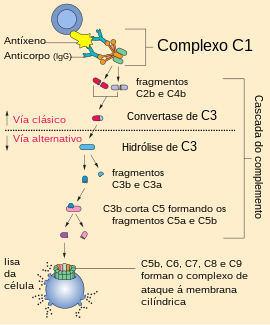
A convertase de C3 ou C3 convertase (EC 3.4.21.43), tamén chamada convertase C3/C5 da vía do complemento clásica, C overbar 42 , C4b,2a, C overbar 423, C4b,2a,3b, C42, C423, C4b,2a,3b, complemento C.hivin.4.hivin2, convertase C3 do complemento, é un encima que pertence a unha familia de serina proteases e forma parte do sistema do complemento da inmunidade innata, que orixina a opsonización de partículas, liberación de péptidos inflamatorios, formación da convertase de C5 e lise celular. Esta convertase cliva a proteína C3, que é a molécula central do sistema do complemento. Pode presentarse en dúas formas (C3bBb e C4bC2a) pero ambas as dúas clivan a proteína C3.
O sistema do complemento pode activarse por tres vías, chamadas clásica, alternativa e da lectina. Todas estas vías de activación levan á clivaxe encimática de C3. Os fragmentos que se orixinan na clivaxe, o C3a e C3b son importantes nos seguintes pasos da fervenza do complemento. O fragmento menor chamado C3a libérase e estimula a inflamación por medio dunha actividade quimioatractora. O fragmento máis grande, C3b, queda unido covalentemente á superficie do microbio ou ás moléculas de anticorpo unidas ao microbio por medio do seu dominio tioéster no sitio de activación do complemento. Despois da clivaxe e a unión á superficie celular, o fragmento C3b está listo para unirse a unha proteína do plasma chamada Factor B. O Factor B (un cimóxeno) é clivado por unha serina protease plasmática chamada Factor D, liberándose un pequeno fragmento chamado Ba e xerando un fragmento máis grande chamado Bb, que permanece unido a C3b. Para formar unha convertase de C3 funcional tamén cómpren ións Mg2+. Así, a convertase de C3 da vía alternativa queda formada e con capacidade de clivar a C3.[1]
Outra forma desta convertase, a convertase de C3 da vía clásica contén diferentes proteínas do sistema do complemento, que son C4b e C2a. Estes fragmentos fórmanse nas vías clásica ou da lectina do complemento. A clivaxe de C4 e C2 está mediada por serina proteases denominadas complexo C1 (C1q, C1r, C1s) da vía clásica, e "serina proteases asociadas a lectina que se liga á manosa" (MASPs: MASP1, MASP2, MASP3) da vía da lectina. C4 é homólogo de C3, e C4b contén un enlace tioéster interno, similar ao de C3b, que forma un enlace amida covalente ou éster co complexo antíxeno-anticorpo ou coa superficie adxacente da célula á cal está unido o anticorpo. C2 é clivado por C1s dando un fragmento máis pequeno chamado C2b e outro máis grande chamado C2a, que se une a C4b. Os fragmentos C4a e C2b son liberados.[1]
Unha vez formadas, ambas as convertases de C3 catalizan a clivaxe proteolítica de C3 orixinando C3a e C3b (de aí o seu nome de "convertase de C3"). C3b pode despois actuar como unha opsonina ou unirse ao complexo C4b2a bimolecular activado para formar un complexo trimolecular, a convertase de C5, que é un encima específico para clivar o C5.
Sitios catalíticos
[editar | editar a fonte]Os sitios catalíticos da convertase de C3 están nas subunidades C2a e Bb. Hai que salientar que as subunidades catalíticas, unha vez disociadas dos seus cofactores, nunca se volven a unir para formar o encima activo.[2] A subunidade Bb ten unha estrutura de dous dominios.[3]
Regulación
[editar | editar a fonte]- As convertases de C3 son inestables (vida media de 10 a 20 minutos), e son respectivamente desactivadas despois da súa disociación espontánea ou por disociación facilitada mediada polos reguladores das proteínas de activación do complemento chamadas factor de aceleración do decaimento (DAF), receptor do complemento 1 (CR1), proteína que se une a C4b e Factor H. A ensamblaxe da convertase é suprimida pola clivaxe proteolítica de C3b (e C4b) e mediada polo Factor I en presenza da proteína cofactor de membrana (MCP, CD46), e da proteína que se une a C4b, CR1, ou a glicoproteína plasmática Factor H. Estes procesos de control negativo son esenciais para a protección dos tecidos propios.[4]
- Properdina (Factor P) é o único regulador positivo coñecido da activación do complemento que estabiliza a vía alternativa das convertases (C3bBb). As persoas deficientes en properdina son sensibles a infeccións pióxenas. A properdina promove a asociación de C3b co Factor B e inhibe a clivaxe de C3b mediada polo Factor H realizada polo Factor I.[5]
A convertase de C3 cliva C3 orixinando C3b, o cal pode formar unha convertase de C3 adicional. Este efecto de retroalimentación positiva é unha característica peculiar da vía alternativa do complemento e dá lugar á deposición de grandes cantidades de moléculas de C3b na superficie das partículas activadoras.[6] Non obstante, este mecanismo de retroalimentación positiva pode ser regulado pola unión a C3b de proteínas de control chamadas glicoproteínas non proteolíticas β1H, o cal impide a captación do Factor B, facilita a disociación-decaimento do Bb que está xa unido a C3b e potencia a inactivación proteolítica de C3b polo inactivador de C3b (C3bINA-endopeptidase). O ácido siálico asociado a membranas promove a unión de alta afinidade de β1H a C3b sen influenciar a afinidade de B por C3b.
O factor acelerante do decaimento (DAF) é outro regulador negativo da convertase de C3. É unha proteína de membrana que regula tamén a convertase de C5 das vías clásica e alternativa. DAF protexe as células do hóspede dos danos que podería producir o complemento autólogo. DAF actúa sobre C2a e Bb e disóciaos rapidamente de C4b e C3b, e así impide a ensamblaxe da convertase de C3.[7]
A proteína que se une a C4 (C4-bp) interfire coa ensamblaxe da convertase C3 unida a membranas da vía clásica. C4-bp é un cofactor para o encima C3bINA. A C4-bp inhibe a función hemolítica do C4b unido ás células. C4-bp e o inactivador de C3b controlan a convertase de C3 da vía clásica de xeito similar ao descrito por β1H e o inactivador de C3b na vía alternativa.[8]
C3b ten un sitio de unión diferente para C3bINA, β1H, o Factor B e a properdina. A unión de β1H a C3b incrementa a unión de C3bINA, mentres que a unión do Factor B impide a unión de C3bINA e é competitivo coa unión de β1H.[9]
A regulación da fase de amplificación da vía alternativa exércese por diversos mecanismos:
- Decaimento intrínseco da convertase de C3.
- Estabilización da convertase de C3 pola properdina.
- Desemsamblaxe deste encima pola glicoproteína sérica β1H.
- Inactivación de C3b polo inactivador de C3b.
- Protección da convertase de C3 da activación destas proteínas de control facilitada polas propiedades da superficie de certas células e outros activadores da vía alternativa.
Unha convertase (de cada tipo) que ten unha 3b adicional (C4b2a3b ou C3bBbC3b) coñécese como "convertase de C5".
A convertase de C3 denominouse, en termos clásicos, C4b2a; na década de 1990 houbo un movemento favorable ao cambio de nomenclatura a C4b2b, pero non tivo éxito.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Abbas AK, Lichtman AH, Pillai S (2010). Cellular and Molecular Immunology. (6th ed.). Elsevier. ISBN 978-1-4160-3123-9.
- ↑ Kerr M (1979). "Limited proteolysis of complement components C2 and Fcator B". Biochem J 183: R615–622.
- ↑ Smith C, Vogel C-W, Müller-Eberhard H (1984). "MHC Class III Products: An Electron Microscopic Study of the C3 Convertases of Human Complement". J Exp Med 159: R324–329.
- ↑ Hourcade D, Holers V M, Atkinson J P (1989). "The regulators of complement activation (RCA) gene cluster". Adv Immunol 45: R381–416.
- ↑ Hourcade D (2006). "The Role of Properdin in the Assembly of the Alternative Pathway C3 Convertases of Complement". J of Biol Chem 281: R2128–2132.
- ↑ Pangburn, M K; Schreiber, R D; Müller-Eberhard, H J (1 de outubro de 1983). "C3b deposition during activation of the alternative complement pathway and the effect of deposition on the activating surface". The Journal of Immunology 131 (4): 1930–1935. PMID 6225800.
- ↑ Fujita T; et al. (1987). "The Mechanism of Action of Decay-Accelarating Factor (DAF)". J Exp Med 166: R1221–1228.
- ↑ Gigli I, Fujita T, Nussenzweig V (1979). "Modulation of the Classical Pathway C3 Convertase by Plasma Proteins C4 Binding Protein and C3b Inactivator". Proc Natl Acad Sci USA 76: R6596–6600.
- ↑ Pangburn M, Müller-Eberhard H (1978). "Complement C3 Convertase: Cell surface restriction of β1H control and generation of restriction on neuroaminidase-treated cells". Proc Natl Acad Sci USA 75: R2416–2420.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- C3 convertase Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.