Dihidrolipoíl transacetilase
| DLAT | |||
|---|---|---|---|
 | |||
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Identificadores externos | |||
| Locus | Cr. 11 q23.1 | ||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A dihidrolipoíl transacetilase (ou dihidrolipoamida acetiltransferase) é un encima compoñente do complexo multiencimático da piruvato deshidroxenase. O complexo da piruvato deshidroxenase é responsable da etapa da descarboxilación do piruvato que liga a glicólise co ciclo do ácido cítrico. Isto implica a transformación do piruvato procedente da glicólise en acetil-CoA, o cal se utiliza despois no ciclo do ácido cítrico para levar a cabo a respiración celular.
Hai tres encimas que compoñen o complexo da piruvato deshidroxenase. A piruvato deshidroxenase (EC 1.2.4.1) é responsable da oxidación do piruvato, a dihidrolipoíl transacetilase (o encima deste artigo; EC 2.3.1.12) transfire o grupo acetilo ao coencima A (CoA), e a dihidrolipoíl deshidroxenase (EC 1.8.1.4) rexenera a lipoamida. Como a dihidrolipoíl transacetilase é o segundo dos tres encimas compoñentes que participan no mecanismo de reacción para a conversión do piruvato a acetil-CoA, ás veces denomínase E2.
En humanos a actividade encimática da dihidrolipoíl transacetilase reside no compoñente E2 do complexo da piruvato deshidroxenase (PDCE2), que está codificado no xene DLAT (dihidrolipoamida S-acetiltransferase) do cromosoma 11 humano.[1]
Nomenclatura
[editar | editar a fonte]O nome sistemático desta clase de encimas é acetil-CoA:encima N6-(dihidrolipoil)lisina S-acetiltransferase.
Outros nomes de uso común son:
- acetil-CoA:dihidrolipoamida S-acetiltransferase,
- acetil-CoA:encima 6-N-(dihidrolipoil)lisina S-acetiltransferase,
- dihidrolipoamida S-acetiltransferase,
- dihidrolipoato acetiltransferase,
- dihidrolipoico transacetilase,
- dihidrolipoil acetiltransferase,
- encima-dihidrolipoillisina:acetil-CoA S-acetiltransferase,
- lipoato acetiltransferase,
- lipoato transacetilase,
- lipoico acetiltransferase,
- ácido lipoico acetiltransferase,
- lipoico transacetilase,
- lipoilacetiltransferase,
- tioltransacetilase A, e
- transacetilase X.
Estrutura
[editar | editar a fonte]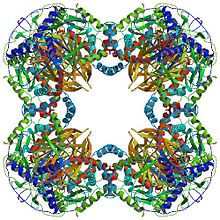
Todas as dihidrolipoíl transacetilases teñen unhs estrutura multidominio única que consta de (de N a C-terminal): 3 dominios lipoíl, un dominio de interacción e o dominio catalítico (ver a arquitectura do dominio en Pfam). Todos os dominios son rexións desordenadas enlazantes de baixa complexidade.
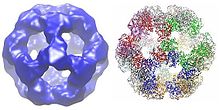
Dependendo da especie, as múltiples subunidades dos encimas dihidrolipoíl transacetilase poden dispoñerse xuntas orixinando unha forma cúbica ou dodecaédrica. Estas estruturas forman despois o corazón catlítico do complexo da piruvato deshidroxenase que non só cataliza a reacción que transfire un grupo acetilo ao CoA, senón que tamén realizan un papel estrutural crucial na creación da arquitectura do complexo global.[3]
Cubo
[editar | editar a fonte]A estrutura central cúbica, atopada en especies como a bacteria Azotobacter vinelandii, está constituída por 24 subunidades en total.[4][5] Os dominios catalíticos están ensamblados en trímeros co sitio activo localizado na interface da subunidade. A topoloxía deste sitio activo trímero é idéntica á da cloranfenicol acetiltransferase. Oito destes trímeros dispóñense formando un cubo truncado oco. Os dous substratos principais, o CoA e a lipoamida (Lip(SH)2), encóntranse nas dúas entradas opostas dunha canle de 30 Å de longo que discorre entre as subiniddes e forma o centro catalítico. O CoA entra desde o interior do cubo e a lipoamida desde o exterior.[6]
Dodecaedro
[editar | editar a fonte]En moitas especies, incluíndo bacterias como Geobacillus stearothermophilus e Enterococcus faecalis [3] así como mamíferos como os humanos[7] e as vacas,[8] a estrutura central dodecaédrica está constituída por un total de 60 subunidades. As subunidades están dispostas en conxuntos de tres, de xeito similar aos trímeros da forma central cúbica, e cada conxunto forma un dos 20 vértices do dodecaedro.
Función
[editar | editar a fonte]| dihidrolipoillisina-residuo acetiltransferase (ou dihidrolipoíl transacetilase) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 2.3.1.12 | ||||||||
| Número CAS | 9032-29-5 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A dihidrolipoíl transacetilase participa na reacción de descarboxilación do piruvato que liga a glicólise co ciclo do ácido cítrico. Estes procesos metabólicos son importantes para a respiración celular (a conversión de enerxía bioquímica obtida dos nutrientes en adenosín trifosfato (ATP), que pode despois utilizarse para levar a cabo numerosas reaccións biolóxicas dentro da célula. As diversas partes da respiración celular teñen lugar en diferentes partes da célula. En eucariotas, a glicólise ocorre no citoplasma, a descarboxilación do piruvato nas mitocondrias, o ciclo do ácido cítrico dentro da matriz mitocondrial, e a fosforilación oxidativa e o transporte de electróns nas cristas mitocondriais. Así, os complexos da piruvato deshidroxenase (que conteñen os encimas dihidrolipoíl transacetilases) atópanse nas mitocondrias dos eucariotas (e simplemente no citosol nos procariotas).
Mecanismo
[editar | editar a fonte]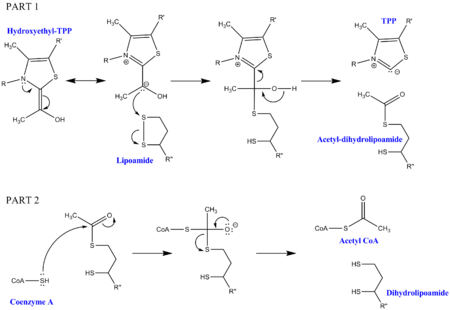
Para a descarboxilación do piruvato cómpren algúns cofactores ademais dos encimas que forman o complexo. O primeiro é a pirofosfato de tiamina (TPP), que é utilizado pola piruvato deshidroxenase para oxidar o piruvato e formar un intermediario hidroxietil-TPP. Este intermediario é captado pola dihidrolipoíl transacetilase e reacciona cun segundo cofactor lipoamida para xerar un intermediario acetil-dihidrolipoíl, liberando TPP no proceso. Este segundo intermediario pode despois ser atacado polo xofre nucleofílico unido a un coencima A, e libérase a dihidrolipoamida. Isto ten como resultado a produción de acetil-CoA, o que é o obxectivo final da descarboxilación do piruvato. A dihidrolipoamida é captada pola dihidrolipoíl deshidroxenase, e cos cofactores adicionais FAD e NAD+, rexenera a lipoamida orixinal (con NADH como subproduto útil).
Importancia clínica
[editar | editar a fonte]Cirrose biliar primaria
[editar | editar a fonte]A cirrose biliar primaria (CBP) é unha enfermidade autoinmune caracterizada pola produción de autoanticorpos contra os antíxenos mitocondrial e nuclear. Estes denomínanse anticorpos antimitocondriais (AMA) e anticorpos antinucleares (ANA), respectivamente. Estes anticorpos son detectables no soro de pacientes con CBP e varían grandemente con respecto á especificidade do epítopo de paciente a paciente. Dos antíxenos mitocondriais que poden xerar reactividade de autoanticorpos nos pacientes de CBP, a subunidade E2 do complexo da piruvato deshidroxenase, que é a dihidrolipoíl transacetilase, é o epítopo máis común (outros antíxenos inclúen encimas dos complexos da 2-oxoácido deshidroxenase, así como outros encimas dos complexos da piruvato deshidroxenase).[9] Evidencias recentes suxiren que o tramo de péptidos do sitio catalítico pode presentar os epítopos inmunodominantes recoñecidos polos anticorpos anti-PDC-E2 en pacientes de CBP.[10] Hai tamén evidencias de anticorpos anti-PDC-E2 na hepatite autoinmune.[11]
Deficiencia de piruvato deshidroxenase
[editar | editar a fonte]A deficiencia de piruvato deshidroxenase é unha enfermidade xenética que orixina acidose láctica e disfunción neurolóxica nos primeiros anos da a infancia. Tipicamente esta doenza é o resultado dunha mutación no xene ligado ao X da subunidade E1α do complexo da piruvato deshidroxenase. Porén, houbo uns poucos casos raros nos cales un paciente con síntomas graves de deficiencia de piruvato deshidroxenase en vez de no X tiñan unha mutación no xene DLAT autosómico da subunidade E2. Estes pacientes teñen síntomas moitos menos graves, e as manifestacións máis prominentes da enfermidade neles eran distonía episódica, aínda que tanto a hipotonía coma a ataxia estaban tamén presentes.[12]
Notas
[editar | editar a fonte]- ↑ Leung PS, Watanabe Y, Munoz S, Teuber SS, Patel MS, Korenberg JR, Hara P, Coppel R, Gershwin ME (1993). "Chromosome localization and RFLP analysis of PDC-E2: the major autoantigen of primary biliary cirrhosis". Autoimmunity 14 (4): 335–40. PMID 8102256. doi:10.3109/08916939309079237.
- ↑ Mattevi A, Obmolova G, Kalk KH, Teplyakov A, Hol WG (abril de 1993). "Crystallographic analysis of substrate binding and catalysis in dihydrolipoyl transacetylase (E2p)". Biochemistry 32 (15): 3887–901. PMID 8471601. doi:10.1021/bi00066a007.
- ↑ 3,0 3,1 3,2 PDB 1B5S; Izard T, Aevarsson A, Allen MD, Westphal AH, Perham RN, de Kok A, Hol WG (febreiro de 1999). "Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes". Proc. Natl. Acad. Sci. U.S.A. 96 (4): 1240–5. Bibcode:1999PNAS...96.1240I. PMC 15447. PMID 9990008. doi:10.1073/pnas.96.4.1240.
- ↑ de Kok A, Hengeveld AF, Martin A, Westphal AH (xuño de 1998). "The pyruvate dehydrogenase multi-enzyme complex from Gram-negative bacteria". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology 1385 (2): 353–66. PMID 9655933. doi:10.1016/S0167-4838(98)00079-X.
- ↑ Hanemaaijer R, Westphal AH, Van Der Heiden T, De Kok A, Veeger C (febreiro de 1989). "The quaternary structure of the dihydrolipoyl transacetylase component of the pyruvate dehydrogenase complex from Azotobacter vinelandii. A reconsideration". European Journal of Biochemistry 179 (2): 287–92. PMID 2917567. doi:10.1111/j.1432-1033.1989.tb14553.x.
- ↑ Mattevi A, Obmolova G, Schulze E, Kalk KH, Westphal AH, de Kok A, Hol WG (marzo de 1992). "Atomic structure of the cubic core of the pyruvate dehydrogenase multienzyme complex". Science 255 (5051): 1544–50. Bibcode:1992Sci...255.1544M. PMID 1549782. doi:10.1126/science.1549782.
- ↑ Brautigam CA, Wynn RM, Chuang JL, Chuang DT (maio de 2009). "Subunit and catalytic component stoichiometries of an in vitro reconstituted human pyruvate dehydrogenase complex". The Journal of Biological Chemistry 284 (19): 13086–98. PMC 2676041. PMID 19240034. doi:10.1074/jbc.M806563200.
- ↑ Zhou ZH, McCarthy DB, O'Connor CM, Reed LJ, Stoops JK (decembro de 2001). "The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes". Proceedings of the National Academy of Sciences of the United States of America 98 (26): 14802–7. Bibcode:2001PNAS...9814802Z. PMC 64939. PMID 11752427. doi:10.1073/pnas.011597698.
- ↑ Mackay IR, Whittingham S, Fida S, Myers M, Ikuno N, Gershwin ME, Rowley MJ (abril de 2000). "The peculiar autoimmunity of primary biliary cirrhosis". Immunological Reviews 174: 226–37. PMID 10807519. doi:10.1034/j.1600-0528.2002.017410.x. Arquivado dende o orixinal o 2013-01-05.
- ↑ Braun S, Berg C, Buck S, Gregor M, Klein R (febreiro 2010). "Catalytic domain of PDC-E2 contains epitopes recognized by antimitochondrial antibodies in primary biliary cirrhosis". World Journal of Gastroenterology 16 (8): 973–81. PMC 2828602. PMID 20180236. doi:10.3748/wjg.v16.i8.973.
- ↑ O'Brien C, Joshi S, Feld JJ, Guindi M, Dienes HP, Heathcote EJ (agosto de 2008). "Long-term follow-up of antimitochondrial antibody-positive autoimmune hepatitis". Hepatology 48 (2): 550–6. PMID 18666262. doi:10.1002/hep.22380.
- ↑ Head RA, Brown RM, Zolkipli Z, Shahdadpuri R, King MD, Clayton PT, Brown GK (agosto de 2005). "Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: dihydrolipoamide acetyltransferase (E2) deficiency". Annals of Neurology 58 (2): 234–41. PMID 16049940. doi:10.1002/ana.20550.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Mattevi A, Obmolova G, Kalk KH, Teplyakov A, Hol WG (Apr 1993). "Crystallographic analysis of substrate binding and catalysis in dihydrolipoyl transacetylase (E2p)". Biochemistry 32 (15): 3887–901. PMID 8471601. doi:10.1021/bi00066a007.
- Brady RO, Stadtman ER (Dec 1954). "Enzymatic thioltransacetylation". The Journal of Biological Chemistry 211 (2): 621–9. PMID 13221570. doi:10.1016/S0021-9258(18)71152-6.
- Gunsalus IC, Barton LS, Gruber W (1956). "Biosynthesis and structure of lipoic acid derivatives". J. Am. Chem. Soc. 78 (8): 1763–1766. doi:10.1021/ja01589a079.
- Perham RN (2000). "Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions". Annual Review of Biochemistry 69: 961–1004. PMID 10966480. doi:10.1146/annurev.biochem.69.1.961.
- Howard MJ, Fuller C, Broadhurst RW, Perham RN, Tang JG, Quinn J, Diamond AG, Yeaman SJ (xullo de 1998). "Three-dimensional structure of the major autoantigen in primary biliary cirrhosis". Gastroenterology 115 (1): 139–46. PMID 9649469. doi:10.1016/S0016-5085(98)70375-0.
- Matsumura S, Kita H, He XS, Ansari AA, Lian ZX, Van De Water J, Yamamoto K, Tsuji T, Coppel RL, Kaplan M, Gershwin ME (novembro de 2002). "Comprehensive mapping of HLA-A0201-restricted CD8 T-cell epitopes on PDC-E2 in primary biliary cirrhosis". Hepatology 36 (5): 1125–34. PMID 12395322. doi:10.1053/jhep.2002.36161.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (outubro de 1997). "Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library". Gene 200 (1–2): 149–56. PMID 9373149. doi:10.1016/S0378-1119(97)00411-3.
- Korotchkina LG, Patel MS (febreiro de 2008). "Binding of pyruvate dehydrogenase to the core of the human pyruvate dehydrogenase complex". FEBS Letters 582 (3): 468–72. PMC 2262399. PMID 18206651. doi:10.1016/j.febslet.2007.12.041.
- Head RA, Brown RM, Zolkipli Z, Shahdadpuri R, King MD, Clayton PT, Brown GK (agosto de 2005). "Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: dihydrolipoamide acetyltransferase (E2) deficiency". Annals of Neurology 58 (2): 234–41. PMID 16049940. doi:10.1002/ana.20550.
- Bogdanos DP, Pares A, Baum H, Caballeria L, Rigopoulou EI, Ma Y, Burroughs AK, Rodes J, Vergani D (xuño de 2004). "Disease-specific cross-reactivity between mimicking peptides of heat shock protein of Mycobacterium gordonae and dominant epitope of E2 subunit of pyruvate dehydrogenase is common in Spanish but not British patients with primary biliary cirrhosis". Journal of Autoimmunity 22 (4): 353–62. PMID 15120760. doi:10.1016/j.jaut.2004.03.002.
- Lleo A, Selmi C, Invernizzi P, Podda M, Coppel RL, Mackay IR, Gores GJ, Ansari AA, Van de Water J, Gershwin ME (marzo de 2009). "Apotopes and the biliary specificity of primary biliary cirrhosis" (PDF). Hepatology 49 (3): 871–9. PMC 2665925. PMID 19185000. doi:10.1002/hep.22736. hdl:2434/55031.
- Bellucci R, Oertelt S, Gallagher M, Li S, Zorn E, Weller E, Porcheray F, Alyea EP, Soiffer RJ, Munshi NC, Gershwin ME, Ritz J (marzo de 2007). "Differential epitope mapping of antibodies to PDC-E2 in patients with hematologic malignancies after allogeneic hematopoietic stem cell transplantation and primary biliary cirrhosis". Blood 109 (5): 2001–7. PMC 1801041. PMID 17068145. doi:10.1182/blood-2006-06-030304.
- Hiromasa Y, Roche TE (setembro de 2003). "Facilitated interaction between the pyruvate dehydrogenase kinase isoform 2 and the dihydrolipoyl acetyltransferase". The Journal of Biological Chemistry 278 (36): 33681–93. PMID 12816949. doi:10.1074/jbc.M212733200.
- Trynka G, Zhernakova A, Romanos J, Franke L, Hunt KA, Turner G, Bruinenberg M, Heap GA, Platteel M, Ryan AW, de Kovel C, Holmes GK, Howdle PD, Walters JR, Sanders DS, Mulder CJ, Mearin ML, Verbeek WH, Trimble V, Stevens FM, Kelleher D, Barisani D, Bardella MT, McManus R, van Heel DA, Wijmenga C (agosto de 2009). "Coeliac disease-associated risk variants in TNFAIP3 and REL implicate altered NF-kappaB signalling". Gut 58 (8): 1078–83. PMID 19240061. doi:10.1136/gut.2008.169052.
- Hiromasa Y, Fujisawa T, Aso Y, Roche TE (febreiro de 2004). "Organization of the cores of the mammalian pyruvate dehydrogenase complex formed by E2 and E2 plus the E3-binding protein and their capacities to bind the E1 and E3 components". The Journal of Biological Chemistry 279 (8): 6921–33. PMID 14638692. doi:10.1074/jbc.M308172200.
- Cori CF (1981). "The glucose-lactic acid cycle and gluconeogenesis". Current Topics in Cellular Regulation 18: 377–87. ISBN 9780121528188. PMID 7273846. doi:10.1016/B978-0-12-152818-8.50028-1.
- Maruyama K, Sugano S (xaneiro de 1994). "Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides". Gene 138 (1–2): 171–4. PMID 8125298. doi:10.1016/0378-1119(94)90802-8.
- Tuganova A, Boulatnikov I, Popov KM (agosto de 2002). "Interaction between the individual isoenzymes of pyruvate dehydrogenase kinase and the inner lipoyl-bearing domain of transacetylase component of pyruvate dehydrogenase complex". The Biochemical Journal 366 (Pt 1): 129–36. PMC 1222743. PMID 11978179. doi:10.1042/BJ20020301.
Ligazóns externas
[editar | editar a fonte]- PDB 1EAA, PDB 1dpb
- Dihydrolipoyl transacetylase Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Relación de toda a información estrutural dispoñible en PDB para UniProt: P10515 (Dihydrolipoyl transacetylase) en PDBe-KB.