Fibrilina
| |
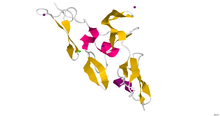
| Estrutura cristalográfica da rexión cbEGF9-híbrido2-cbEGF10 da fibrilina-1 humana.[1] | |
| Identificadores | |
| Símbolo | FBN1 |
| Símbolos alt. | FBN, MFS1, WMS |
| Entrez | 2200 |
| HUGO | 3603 |
| OMIM | |
| PDB | 2W86 |
| RefSeq | NM_000138 |
| UniProt | P35555 |
| Outros datos | |
| Locus | Cr. 15 q21.1 |
Fibrilina-2
| |
| Identificadores | |
| Símbolo | FBN2 |
| Símbolos alt. | CCA |
| Entrez | 2201 |
| HUGO | 3604 |
| OMIM | |
| RefSeq | NM_001999 |
| UniProt | P35556 |
| Outros datos | |
| Locus | Cr. 5 q23-q31 |
Fibrilina-3
| |
| Identificadores | |
| Símbolo | FBN3 |
| Entrez | 84467 |
| HUGO | 18794 |
| OMIM | |
| RefSeq | NM_032447 |
| UniProt | Q75N90 |
| Outros datos | |
| Locus | Cr. 19 p13 |
A fibrilina é unha glicoproteína que é esencial para a formación de fibras elásticas do tecido conectivo.[2] A fibrilina segrégana os fibroblastos á matriz extracelular e incorpórase ás microfibrilas insolubles, as cales parecen proporcionar un armazón para a deposición de elastina.[3]
Aspectos clínicos
[editar | editar a fonte]A síndrome de Marfan é un trastorno xenético que afecta o tecido conectivo causado por un defecto no xene FBN1. As mutacións en FBN1 (e en FBN2) están por veces tamén asociadas coa escoliose idiopática adolescente.[4]
Tipos
[editar | editar a fonte]Fibrilina-1
[editar | editar a fonte]A fibrilina-1 é o principal compoñente das microfibrilas que forman unha vaíña arredor da elastina amorfa. Crese que as microfibrilas están compostas por un polímero cola-con-cola de fibrilina. Ata agora describíronse en humanos 3 formas de fibrilina e un 4º tipo descubriuse en peixes. A fibrilina-1 illouna Engvall en 1986,[5] e as mutacións no xene FBN1 que a codifica causan a síndrome de Marfan.[6][7]
Esta proteína encóntrase en humanos e o seu xene está situado no cromosoma 15. Ata o momento describíronse máis de 1500 mutacións distintas neste xene.[1][7]
Non se obtivo a estrutura completa e de alta resolución da fibrilina-1. No seu lugar, producíronse fragmentos curtos por recombinación e as súas estruturas foron resoltas por cristalografía de raios X ou usando espectrometría de RMN. Un exemplo recente é a estrutura do dominio híbrido2 da fibrilina-1, obtida en contexto cos seus dominios de factor de crecemento epidérmico de unión ao calcio que o flanquean, que foi determinada usando cristalografía de raios X a unha resolución de 1,8 Å.[1] As microfibrilas que están feitas da proteína fibrilina son responsables de diferentes interaccións célula-matriz no corpo humano.
Fibrilina-2
[editar | editar a fonte]A fibrilina-2 foi illada en 1994 por Zhang[8] e pénsase que xoga un papel na elastoxénese temperá. As mutacións no xene da fibrilina-2 foron ligadas á síndrome de Beals.
Fibrilina-3
[editar | editar a fonte]Máis recentemente, describiuse a fibrilina-3 e crese que se localiza principalmente no cerebro.[9] Ademais, tamén foi detectada nos testículos e ovarios de ratos de campo.
Fibrilina-4
[editar | editar a fonte]A fibrilina-4 descubriuse primeiramente no peixe cebra e ten unha secuencia similar á da fibrilina-2.[10]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 PDB 2W86; Jensen SA, Iqbal S, Lowe ED, Redfield C, Handford PA (maio de 2009). "Structure and interdomain interactions of a hybrid domain: a disulphide-rich module of the fibrillin/LTBP superfamily of matrix proteins". Structure 17 (5): 759–68. PMC 2724076. PMID 19446531. doi:10.1016/j.str.2009.03.014.
- ↑ Kielty CM, Baldock C, Lee D, Rock MJ, Ashworth JL, Shuttleworth CA (febreiro de 2002). "Fibrillin: from microfibril assembly to biomechanical function". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 357 (1418): 207–17. PMC 1692929. PMID 11911778. doi:10.1098/rstb.2001.1029.
- ↑ Singh (2011). Textbook of human histology (PDF). Jaypee Brothers Publishers. ISBN 978-93-80704-34-0. Consultado o 24 de febreiro de 2023.[Ligazón morta]
- ↑ Buchan JG, Alvarado DM, Haller GE, Cruchaga C, Harms MB, Zhang T, Willing MC, Grange DK, Braverman AC, Miller NH, Morcuende JA, Tang NL, Lam TP, Ng BK, Cheng JC, Dobbs MB, Gurnett CA (outubro de 2014). "Rare variants in FBN1 and FBN2 are associated with severe adolescent idiopathic scoliosis". Human Molecular Genetics 23 (19): 5271–82. PMC 4159151. PMID 24833718. doi:10.1093/hmg/ddu224.
- ↑ Sakai LY, Keene DR, Engvall E (decembro de 1986). "Fibrillin, a new 350-kD glycoprotein, is a component of extracellular microfibrils". The Journal of Cell Biology 103 (6 Pt 1): 2499–509. PMC 2114568. PMID 3536967. doi:10.1083/jcb.103.6.2499.
- ↑ Dietz HC (agosto de 2010). "New therapeutic approaches to mendelian disorders". The New England Journal of Medicine 363 (9): 852–63. PMID 20818846. doi:10.1056/NEJMra0907180.
- ↑ 7,0 7,1 von Kodolitsch Y, De Backer J, Schüler H, Bannas P, Behzadi C, Bernhardt AM, Hillebrand M, Fuisting B, Sheikhzadeh S, Rybczynski M, Kölbel T, Püschel K, Blankenberg S, Robinson PN (2015). "Perspectives on the revised Ghent criteria for the diagnosis of Marfan syndrome". The Application of Clinical Genetics 8: 137–55. PMC 4476478. PMID 26124674. doi:10.2147/TACG.S60472.
- ↑ Zhang H, Apfelroth SD, Hu W, Davis EC, Sanguineti C, Bonadio J, Mecham RP, Ramirez F (marzo de 1994). "Structure and expression of fibrillin-2, a novel microfibrillar component preferentially located in elastic matrices". The Journal of Cell Biology 124 (5): 855–63. PMC 2119952. PMID 8120105. doi:10.1083/jcb.124.5.855.
- ↑ Corson GM, Charbonneau NL, Keene DR, Sakai LY (marzo de 2004). "Differential expression of fibrillin-3 adds to microfibril variety in human and avian, but not rodent, connective tissues". Genomics 83 (3): 461–72. PMID 14962672. doi:10.1016/j.ygeno.2003.08.023.
- ↑ Gansner JM, Madsen EC, Mecham RP, Gitlin JD (outubro de 2008). "Essential role for fibrillin-2 in zebrafish notochord and vascular morphogenesis". Developmental Dynamics 237 (10): 2844–61. PMC 3081706. PMID 18816837. doi:10.1002/dvdy.21705.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Fibrillin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.