Glicosa-6-fosfatase
| Glicosa-6-fosfatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 3.1.3.9 | ||||||||
| Número CAS | 9001-39-2 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A glicosa-6-fosfatase ou glicosa 6-fosfatase (número EC 3.1.3.9, abreviada como G6Pase ou Glc 6-Pase) é un encima que hidroliza a glicosa 6-fosfato orixinando glicosa e fosfato libres. A G6Pase hepática é unha proteína integral de membrana do retículo endoplasmático co sitio activo no lume de dito orgánulo.[1] A glicosa producida é despois exportada da célula por medio dun transportador de glicosa de membrana.[2] Esta reacción é o paso final das rutas metabólicas da gliconeoxénese e a glicoxenólise e, por tanto, xoga un papel fundamental na regulación dos niveis de glicosa sanguínea.[3]
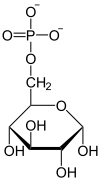 |
H2O Pi Glicosa-6-fosfatase |

|
| α-D-Glicosa 6-fosfato | α-D-Glicosa |
Isoencimas
[editar | editar a fonte]Nos humanos hai tres isoencimas chamados G6PC (ou G6Pase-α, funcional [4]), G6PC2 (sen actividade de fosfohidrolase), e G6PC3 (ou G6Pase-β, funcional[5]).
As dúas fosfohidrolases funcionais humanas da familia das G6Pase están asociadas ao retículo endoplasmático e son a G6Pase-α (de fígado, riles e intestino) e a G6Pase-β (ubicua por todo o corpo). A G6Pase-α e a G6Pase-β comparten unha estrutura similar do sitio activo, topoloxía, mecanismo de acción, e propiedades cinéticas en relación coa hidrólise da glicosa 6-fosfato.[6]
Estrutura e función
[editar | editar a fonte]Aínda que non se chegou a un consenco total, para explicar as propiedades catalíticas da G6Pase moitos dos científicos do ramo son partidarios do modelo do transporte de substrato. Neste modelo, a G6Pase ten un baixo grao de selectividade. A transferencia da glicosa 6-fosfato lévaa a cabo unha proteína de transporte (T1) e o retículo endoplasmático contén estruturas que permiten a saída do grupo fosfato (proteína T2) e da glicosa (T3).[7]
A G6Pase consta de 357 residuos de aminoácidos, e está ancorada nas membranas do retículo endoplasmático por medio de nove hélices transmembrana. O seu extremo N-terminal e o sitio activo encóntranse no lado luminal do retículo endoplasmático e o extremo C-terminal proxéctase ao citosol. Debido á súa estreita asociación co retículo endoplasmático, a estrutura exacta do encima non se coñece ben, xa que é moi difícil de separar da membrana. Porén, os aliñamentos de secuencias indican que a G6Pase é estruturalmente similar ao sitio activo da cicloperoxidase que contén vanadio que se encontra en fungos do xénero Curvularia.[8]
Baseándose en estudos cinéticos de pH da catálise realizada pola G6Pase-α, propúxose que a hidrólise da glicosa 6-fosfato se completa por medio dun intermediato covalente fosfohistidina. O sitio activo da G6Pase-α foi identificado inicialmente pola presenza dun motivo sinatura conservado fosfato que se encontra nas lípido fosfatases, e nas vanadio haloperoxidases.[6]
Os residuos esenciais no sitio activo das vanadio haloperoxidases son: Lys353, Arg360, Arg490, His404, e His496. Os residuos correspondentes no sitio activo da G6Pase-α inclúen a Arg170 e Arg83, os cales doan ións hidróxeno ao fosfato, estabilizando o estado de transición, xunto coa His119, que proporciona un protón ao oxíxeno desfosforilado unido á glicosa, e a His176, que completa o ataque nucleofílico sobre o fosfato para formar un intermediato fosforil encima unido covalentemente.[2] Na cloroperoxidase que contén vanadio, a Lys353 estabiliza o fosfato no estado de transición. Porén, o residuo correspondente na G6Pase-α (Lys76) está situado dentro da membrana do retículo endoplasmático e a súa función, se é que ten algunha, non se coñece actualmente. Coa excepción da Lys76, estes residuos están todos localizados no lado luminal da membrana do retículo endoplasmático.[6]
A G6Pase-β exprésase ubicuamente, é unha proteína de membrana de 346 residuos de aminoácidos que comparte un 36% de identidade de secuencia coa G6Pase-α. Na G6Pase-β os aliñamentos de secuencia predín que o seu sitio activo contén His167, His114, e Arg79. Igual que no sitio activo da G6Pase-α, a His167 é o residuo que realiza o ataque nucleofílico, mentres que a His114, e a Arg79 son os doantes de hidróxenos. A G6Pase-β está tamén localizada na membrana do retículo endoplasmático, mais a súa orientación non se coñece.[6]
Mecanismo
[editar | editar a fonte]A hidrólise da glicosa 6-fosfato empeza cun ataque nucleofílico ao fosfato unido ao azucre feito polo residuo His176, que dá lugar á formación dun enlace fosfohistidina e á degradación do carbonilo. Un oxíxeno cargado negativamente transfire despois os seus electróns volvendo a formar un carbonilo e rompendo o seu enlace coa glicosa. O oxíxeno unido á glicosa cargado negativamente é despois protonado pola His119 formando glicosa libre. O fosfo-intermediato producido pola reacción entre a His176 e o grupo fosfato rompe despois por un ataque nucleofílico; despois da adición doutro hidróxido e a descomposición do carbonilo, o carbonilo volve a formarse expulsando os electróns doados orixinalmente polo residuo de His176, creando deste modo un grupo fosfato libre e completando a hidrólise.[2]
Expresión
[editar | editar a fonte]Os xenes que codifican este encima exprésanse principalmente no fígado, córtex renal e (en menor medida) nas células β dos illotes pancreáticos e a mucosa intestinal (especialmente durante períodos nos que se pase fame).[7] Segundo Surholt e Newsholme, a G6Pase está presente no músculo de numerosas especies animais, pero só a moi pequenas concentracións.[9] Deste modo, ao haber tan pouco deste encima, o glicóxeno que se almacena nos músculos non está xeralmente dispoñible para o resto das células do corpo porque a glicosa 6-fosfato non pode cruzar o sarcolema (membrana da célula muscular) a non ser que sexa desfosforilada. O encima xoga un importante papel durante os períodos de xaxún e cando os niveis de glicosa son baixos. Observouse que a inanición e a diabetes inducen un incremento en 2-3 veces na actividade da G6Pase no fígado.[7] A actividade da G6Pase tamén se incrementa drasticamente no nacemento cando o organismo se fai independente das fontes de glicosa de procedencia materna. O xene da G6Pase contén cinco exóns que abranguen aproximadamente 125,5 kb do ADN localizados no cromosoma 17 (locus 17q21.31).[10]
Importancia clínica
[editar | editar a fonte]As mutacións no sistema da G6Pase, especificamente na subunidade glicosa-6-fosfatase-α (G6Pase- α), ou no transportador de glicosa 6-fosfato (G6PT), ou na subunidade glicosa-6-fosfatase-β (G6Pase-β ou G6PC3) orixinan deficiencias no mantemento da homeostase da glicosa interprandial e no funcionamento dos neutrófilos.[11][12] As mutacións na G6Pase-α e no G6PT orixinan a enfermidade de almacenamento de glicóxeno de tipo 1 (GSD-1) chamada enfermidade de von Gierke.[13] As mutacións na G6Pase-α causan unha enfermidade de almacenamento do glicóxeno de tipo 1a, que se caracteriza pola acumulación de glicóxeno e graxas no fígado e riles, que orixina hepatomegalia e renomegalia.[14] A GSD-1a constitúe aproximadamente o 80% dos casos de GSD-1 que se presentan clinicamente.[15] A ausencia de G6PT dá lugar á enfermidade de almacenamento de glicóxeno de tipo 1b (GSD-1b), que se caracteriza pola falta de G6PT e supón o 20% dos casos que se presentan clinicamente.[15][16]

A causa específica dunha GSD-1a son mutacións sen sentido, insercións/delecións con ou sen corremento da pauta de lectura, ou mutacións no sitio de splicing que ocorren nos xenes.[7] As mutacións sen sentido afectan aos dous longos bucles luminais e ás hélices transmembrana da G6Pase-α, que suprimen ou reducen moito a actividade do encima.[7] A causa específica da GSD-1b son mutacións "graves" como mutacións no sitio de splicing, mutacións de cambio de pauta de lectura, e substitucións dun residuo moi conservado que destrúen completamente a actividade G6PT.[7] Estas mutacións orixinan a GSD-1 ao impediren o transporte de glicosa 6-fosfato (G6P) na porción luminal do retículo endoplasmático e tamén ao inhibiren a conversión de glicosa 6-fosfato en glicosa para ser usada pola célula.
O terceiro tipo de deficiencia de G6Pase é a deficiencia de G6Pase-β, que se caracteriza por unha síndrome de neutropenia conxénita na cal os neutrófilos mostran un aumento do estrés do retículo endoplasmático, incremento da apoptose, afectación da homeostase enerxética, e perda de funcionalidade.[17] Pode levar tamén a desenvolver malformacións cardíacas e uroxenitais.[18] Esta terceira clase de deficiencia tamén se ve afectada por unha deficiencia en G6PT, xa que a G6Pase-β tamén está situada no lume do retículo endoplasmático, o que pode facer que os síntomas similares da deficiencia de G6Pase-β sexan asociados con GSD-1b.[16] Ademais, investigacións recentes estudaron esta zona de semellanza entre as dúas deficiencias e mostraron que ocorre unha glicosilación anormal en ambas as deficiencias.[19] A glicosilación de certos encimas dos neutrófilos (como a NADPH oxidase) ten un profundo efecto na actividade dos neutrófilos e pode clasificarse tamén como un trastorno de glicosilación conxénito.[19]
A principal función da G6Pase-β é proporcionar glicosa reciclada ao citoplasma dos neutrófilos para manter o seu funcionamento normal. A distorsión da proporción de glicosa con respecto a glicosa 6-fosfato debido a unha diminución significativa dos niveis de glicosa intracelular causa unha alteración significativa da glicólise e da vía da pentosa fosfato.[12] A non ser qur se contrarreste con captación de glicosa extracelular, esta deficiencia dá lugar a unha disfunción dos neutrófilos.[12]
Notas
[editar | editar a fonte]- ↑ Burchell A, Hume R. The glucose-6-phosphatase system in human development. Histol Histopathol. 1995 Oct;10(4):979-93. PMID 8574017. [1]
- ↑ 2,0 2,1 2,2 Ghosh A, Shieh JJ, Pan CJ, Sun MS, Chou JY (2002). "The catalytic center of glucose-6-phosphatase. HIS176 is the nucleophile forming the phosphohistidine-enzyme intermediate during catalysis". J. Biol. Chem. 277 (36): 32837–42. PMID 12093795. doi:10.1074/jbc.M201853200.
- ↑ Nordlie R; et al. (1985). The Enzymes of biological membranes, 2nd edition. New York: Plenum Press. pp. 349–398. ISBN 0-306-41453-8.
- ↑ CHEMBL Glucose-6-phosphatase
- ↑ OMIM G6PC3 [2]
- ↑ 6,0 6,1 6,2 6,3 Ghosh A, Shieh JJ, Pan CJ, Chou JY (2004). "Histidine 167 is the phosphate acceptor in glucose-6-phosphatase-beta forming a phosphohistidine enzyme intermediate during catalysis". J. Biol. Chem. 279 (13): 12479–83. PMID 14718531. doi:10.1074/jbc.M313271200.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 van Schaftingen E, Gerin I (2002). "The glucose-6-phosphatase system". Biochem. J. 362 (Pt 3): 513–32. PMC 1222414. PMID 11879177. doi:10.1042/0264-6021:3620513.
- ↑ Pan CJ, Lei KJ, Annabi B, Hemrika W, Chou JY (1998). "Transmembrane topology of glucose-6-phosphatase". J. Biol. Chem. 273 (11): 6144–8. PMID 9497333. doi:10.1074/jbc.273.11.6144. Arquivado dende o orixinal o 30 de maio de 2020. Consultado o 11 de xaneiro de 2014.
- ↑ B Surholt and E A Newsholme. Maximum activities and properties of glucose 6-phosphatase in muscles from vertebrates and invertebrates. Biochem J. 1981 September 15; 198(3): 621–629. [3]
- ↑ Angaroni CJ, de Kremer RD, Argaraña CE; et al. (2004). "Glycogen storage disease type Ia in Argentina: two novel glucose-6-phosphatase mutations affecting protein stability". Mol. Genet. Metab. 83 (3): 276–9. PMID 15542400. doi:10.1016/j.ymgme.2004.06.010.
- ↑ Chou JY, Jun HS, Mansfield BC (2010). "Glycogen storage disease type I and G6Pase-β deficiency: etiology and therapy". Nature Reviews Endocrinology 6 (12): 676–88. PMID 20975743. doi:10.1038/nrendo.2010.189.
- ↑ 12,0 12,1 12,2 Jun HS, Lee YM, Cheung YY; et al. (2010). "Lack of glucose recycling between endoplasmic reticulum and cytoplasm underlies cellular dysfunction in glucose-6-phosphatase-beta-deficient neutrophils in a congenital neutropenia syndrome". Blood 116 (15): 2783–92. PMC 2974586. PMID 20498302. doi:10.1182/blood-2009-12-258491.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2007). Biochemistry. San Francisco: W.H. Freeman. ISBN 0-7167-8724-5.
- ↑ Pagon RA, Bird TD, Dolan CR; et al. (19 de abril de 2006). "Glycogen Storage Disease Type I." (en inglés). PMID 20301489.
- ↑ 15,0 15,1 Chou JY, Matern D, Mansfield BC, Chen YT (2002). "Type I glycogen storage diseases: disorders of the glucose-6-phosphatase complex". Curr. Mol. Med. 2 (2): 121–43. PMID 11949931. doi:10.2174/1566524024605798.
- ↑ 16,0 16,1 Froissart R, Piraud M, Boudjemline AM; et al. (2011). "Glucose-6-phosphatase deficiency". Orphanet J Rare Dis 6: 27. PMC 3118311. PMID 21599942. doi:10.1186/1750-1172-6-27.
- ↑ Jun HS, Lee YM, Song KD, Mansfield BC, Chou JY (2011). "G-CSF improves murine G6PC3-deficient neutrophil function by modulating apoptosis and energy homeostasis". Blood 117 (14): 3881–92. PMC 3083300. PMID 21292774. doi:10.1182/blood-2010-08-302059.
- ↑ Boztug K, Appaswamy G, Ashikov A; et al. (2009). "A syndrome with congenital neutropenia and mutations in G6PC3". N. Engl. J. Med. 360 (1): 32–43. PMC 2778311. PMID 19118303. doi:10.1056/NEJMoa0805051.
- ↑ 19,0 19,1 Hayee B, Antonopoulos A, Murphy EJ; et al. (2011). "G6PC3 mutations are associated with a major defect of glycosylation: a novel mechanism for neutrophil dysfunction". Glycobiology 21 (7): 914–24. PMC 3110488. PMID 21385794. doi:10.1093/glycob/cwr023.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Glucose-6-Phosphatase Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- G6PC, G6PC2, G6PC3, G6PR
