Plastoquinona
| Plastoquinona | |
|---|---|
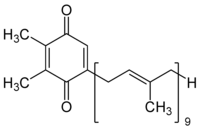 | |
Outros nomes PIN: 2,3-Dimetil-5-[(2''E'',6'''E'',10''E'',14''E'',18''E'',22''E'',26''E'',30''E'')-3,7,11,15,19,23,27,31,35-nonametilhexatriaconta-2,6,10,14,18,22,26,30,34-nonaen-1-il]ciclohexa-2,5-dieno-1,4-diona | |
| Identificadores | |
| Número CAS | 4299-57-4 |
| PubChem | 6433402 |
| ChemSpider | 10627857 |
| UNII | OAC30J69CN |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C53H80O2 |
| Masa molar | 749,20 g mol−1 |
| Compostos relacionados | |
| Compostos relacionados | 1,4-benzoquinone quinona coencima Q10 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

A plastoquinona[1] (PQ)[2] é unha molécula do grupo das quinonas que intervén no transporte de electróns que ten lugar na fase luminosa da fotosíntese. O prefixo plasto do seu nome alude á súa localización nos plastos (fundamentalmente cloroplastos).[3] A plastoquinona redúcese a plastoquinol (PQH2) ao captar dous protóns (H+) procedentes do estroma do cloroplasto e recibir dous electróns (e-) procedentes do fotosistema II fotosintético. Transporta os protóns cara á luz dos tilacoides (ao reaccionar co citocromo b6f), e os electróns pasan ao seguinte transportador de electróns da cadea fotosintética, que é o complexo citocromo b6f. É unha molécula moi móbil na membrana tilacoidal.
Estruturalmente é unha 2,3-dimetil-1,4-benzoquinona cunha cadea lateral de nove unidades isoprenilo.
Tipos
[editar | editar a fonte]En 1946, M. Kofler descubriu a plastoquinona, que será reedescuberta por F. L. Crane en 1959.[4] A plastoquinona (PQ) orixinouse evolutivamente nas cianobacterias. É unha quinona de orixe isoprenoide clave na fotosíntese oxixénica das cianobacterias e de todas as plantas, polo seu papel na transferencia de electróns e protóns.[5]
A plastoquinona atópase nos cloroplastos, basicamente en dous lugares: nos tilacoides e na membrana interna dos cloroplastos, que é onde se sintetiza. Porén, non é exclusiva dos órganos fotosintetizadores, porque se atopa en pequenas cantidades en todos os órganos vexetais (raíz, bulbos, flores, froitos etc.).[6]
Habitualmente, a plastoquinona contén unha cadea lateral nonaprenil isoprenoide (PQ-9, PQA), aínda que nalgunhas especies de plantas se encontraron outras cadeas laterais homólogas en menor proporción, como por exemplo: a PQ-8 no trigo e na ficus elástica, o PQ-4 no castiñeiro de Indias e o PQ-3 nas espinacas. Tamén se informou da presenza de dimetilplastoquinonas, como a 3-dimetilplastoquinona-8 e a 3-dimetilplastoquinona-9 nos bulbos de Iris hollandica.[7]
Outras formas de plastoquinona identificadas son a PQ-C e a PQ-B.[8] Estas dúas formas derivan da PQ-9 e cada unha delas representa un grupo de como mínimo 6 isómeros. A PQ-C contén un grupo hidroxilo na cadea lateral prenil e a PQ-B é o éster de ácido graxo da PQ-C. Porén, a estrutura exacta de cada isómero da plastoquinona aínda non está determinada. Tampouco se coñece se estes compostos se sintetizan de novo ou son produtos da degradación da PQ-A, nin se ambos os isómeros teñen algunha función específica. Porén, o que si sabemos é que a PQ-C se acumula nas follas máis vellas e que os compostos semellantes á PQ-C se forman a partir da PQ-9, durante a reacción de eliminación do oxíxeno singulete. Esta trátase dunha molécula de oxíxeno moi reactiva, xa que contén electróns excitados; conséguese neutralizar oxidando á PQ-9. Este feito podería indicar que a PQ-C é un produto non encimático da oxidación da PQ-9, sen ningunha función especial. Ademais, demostrouse que tanto a PQ-C coma a PQ-B poden substituír a PQ-9 e actuar como aceptores de electróns do fotosistema II.
Biosíntese
[editar | editar a fonte]Na molécula de plastoquinona podemos diferenciar dúas partes: unha cabeza (unha estrutura cíclica) e unha cadea lateral formada por un grupo prenil (derivado do isopreno). O precursor do grupo funcional que constitúe a cabeza (homoxentisato, abreviado como HGA) deriva da tirosina e a cadea lateral prenil fórmase nunha vía metabólica denominada DXP. A condensación do grupo funcional da cabeza é catalizada por un encima denominado homoxentisato solanesil transferase. A prenilación do HGA é tamén un paso importante na biosíntese de vitamina E. Despois da condensación, ten lugar a reacción de metilación que orixina o produto final: a plastoquinona. A reacción de condensación suponse que ten lugar na membrana interna dos cloroplastos, malia que nas espinacas tamén se suxeriu que ten lugar no retículo endoplasmático e no aparato de Golgi.
A vía biosintética da plastoquinona que se acaba de describir é a que se produce nas plantas e algas, mais hai indicios de que nas cianobacterias o camiño seguido é diferente. A Synechocystis sp. PCC 6803 mutante non pode formar vitamina E, pero si que pode sintetizar plastoquinona. Isto suxire que nas cianobacterias non se require HGA para a biosíntese de plastoquinona, entanto que nas plantas superiores é un intermediario necesario. Por outra parte, nos xenomas de cianobacterias non se atoparon homólogos da HGA feniltransferase (un encima que participa nas reaccións de síntese da plastoquinona a partir do HGA), o cal indica que, neses organismos, a plastoquinona segue outra ruta de biosíntese. Para aclarar totalmente a cuestión requiriranse máis estudos.
Funcións
[editar | editar a fonte]A súa principal misión é fotosintética. É un dos transportadores de electróns fotosintéticos. Contribúe á acumular protóns dentro dos tilacoides, polo que axuda a crear o gradiente de protóns necesario para activar a fotofosforilación. Outras funcións son intervir na chamada clororrespiración, funcionar como antioxidante, controlar a expresión de xenes fotosintéticos, e outras.
A plastoquinona forma parte da cadea transportadora de electróns dependente da luz da fase luminosa acíclica da fotosíntese. A súa función principal é recibir electróns da feofitina, un tipo de clorofila sen magnesio do fotosistema II, e transportalos ao citocromo b6f, onde terá lugar o bombeo de dous protóns ao interior do tilacoide. Estes dous protóns, xunto cos producidos durante a fotólise da auga, crearán unha diferenza de potencial electroquímico que permitirá a saída dos protóns pola ATP sintetase, e a produción de ATP. Este proceso denomínase fotofosforilación do ADP.

Para realizar esta función séguese un complexo proceso. Inicialmente, hai unha molécula de plastoquinona que está fortemente agregada ás proteínas do fotosistema II, concretamente nun lugar de unión denominado QA. Esta molécula recibe un electrón da feofitina e transfíreo a outra molécula de plastoquinona, que está debilmente fixada noutro punto de unión: o QB. Cando a plastoquinona captou dous electróns e un protón, redúcese a PQH2 e disóciase do centro QB e, desta maneira, entra a formar parte do conxunto móbil de PQH2 da membrana do tilacoide. Posteriormente, a reoxidación da PQH2, que ten lugar no complexo do citocromo b6f, orixina a translocación dun protón a través da membrana. O modo en que a PQ transporta os protóns é interaccionando co citocromo b6f.
Os resultados das reaccións redox do citocromo b559 en presenza de plastoquinona indican que existe un terceiro sitio de unión de PQ ao fotosistema II, que se denomina QC. Este punto identificouse recentemente na estrutura cristalizada do fotosistema II de cianobacterias.[9] Á parte da súa contribución na fase acíclica, a plastoquinona tamén está involucrada no ciclo Q que depende do citocromo b6f e que é similar ao que se produce na mitocondria, xa que a PQH2 se oxida completamente a PQ e así se transfiren dous protóns ao interior do tilacoide (non ao espazo intermembrana). De feito, nas cianobacterias a plastoquinona, ademais de participar na cadea transportadora de electróns da fotosíntese, tamén contribúe á respiración celular, xa que nestas bacterias ambos os dous procesos teñen lugar nas membranas do tilacoide (a respiración nas cianobacterias ten lugar tanto na membrana plasmática coma nos tilacoides)[10]. Por outra parte, no caso dos tilacoides das plantas superiores e das algas tamén se identificaron outras proteínas que interaccionan coa PQ.
Papel na clororrespiración
[editar | editar a fonte]Recentemente, definiuse o proceso da clororrespiración como unha cadea transportadora de electróns que interacciona co transporte electrónico e que ten lugar durante a fotosíntese nas membranas dos tilacoides. Neste proceso interveñen por un lado un complexo NADPH deshidroxenase (NDH), un encima redutor codificado polos xenes ndh [11] do plasto, homólogo ao complexo I bacteriano, e, por outro, unha oxidase terminal de plastos (PTOX) codificada por ADN nuclear, homóloga da oxidase alternativa da mitocondria da planta. A oxidase da clororrespiración oxida a PQH2 utilizando peróxido de hidróxeno e a forma de potencial baixa do citocromo b559 do fotosistema II.[12] Durante a clororrespiración independente da luz, a PQ oxida o NAD(P)H encimaticamente por medio dos encimas NDH e seguidamente transfire electróns ao oxíxeno, coa colaboración das oxidases. A función destas proteínas na redución e oxidación de plastoquinonas independente da luz demostrouse nos últimos anos.
Nos tilacoides dos cloroplastos maduros, a clororrespiración parece ser ser unha vía relativamente menor, comparada coa da cadea transportadora de electróns fotosintética, desde a H2O deica o NADP+. Porén, a clororrespiración probablemente ten un papel na regulación da fotosíntese, xa que modularía a actividade do transporte de electróns cíclico no fotosistema I. Nos plastos non fotosintéticos, os transportadores de electróns da clororrespiración son máis abundantes e terían un importante papel bioenerxético. As moléculas de plastoquinona presentan unha gran mobilidade, tanto transversal coma lateral, cousa que lles permite transferir electróns a grandes distancias entre o fotosistema II e os complexos citocromo b6f ás membranas do tilacoide e tamén bombear protóns a través da membrana. Como a lonxitude da secuencia liñal da molécula de PQ é case da mesma medida que o grosor da membrana, a difusión de PQ é máis eficiente entre a rexión fluída e hidrofóbica da membrana, coa cadea lateral hidrofóbica disposta de forma paralela á superficie da membrana.[13] Porén, o grupo funcional da cabeza da PQ ten tendencia a penetrar na rexión interfásica onde están os complexos proteicos que conteñen os sitios de unión da PQ. A cabeza da PQH2, formada despois de que o fotosistema II reducise á PQ é máis polar ca o da PQ e, por tanto, ocupa máis rexións polares da membrana. Esta PQH2 debe cruzar a membrana ata chegar ao complexo do citocromo b6f para oxidarse.
En diversos experimentos modelo os resultados obtidos suxiren que as moléculas de PQ tanto reducidas coma oxidadas forman un complexo de transferencia que facilita a penetración da PQH2 ao interior das membranas hidrofóbicas. Nestes estudos demóstrase que a formación do complexo de transferencia incrementa a solubilidade da PQH2 en solventes hidrofóbicos, da mesma maneira que diminúe o contido de PQH2 á rexión interfásica da monocapa de monogalactosildiacilglicerol.[14] Polo contrario, en estudos de anisotropía de difenilhexatrieno, unha sonda fluorescente que controla a orde da membrana lipídica, encontrouse que algunhas formas da PQ teñen unha tendencia a ocupar diferentes rexións da membrana.
Outras funcións
[editar | editar a fonte]Ademais da súa función principal, a PQ ten outras. A PQH2 ten unha actividade antioxidante pronunciada, similar á dos tocoferois e á da ubiquinona reducida. Tamén se probou en numerosos experimentos, feitos tanto in vitro coma in vivo, que PQH2 inhibe a peroxidación dos lípidos da membrana e que elimina de forma eficiente os radicais superóxido e oxíxeno singulete. Observacións feitas en vexetais do xénero Arabidopsis permitiron constatar que, en condicións de estrés oxidativo, a plastoquinona se acumula no seu estado reducido (PQH2), polo que parece ser que, nesas condicións, esta molécula tamén desenvolve funcións que son un mecanismo de defensa. Recentemente tamén se demostrou a función da plastoquinona na reacción ao estrés térmico. Observouse nas follas máis vellas das plántulas de cebada que, baixo tratamento térmico, se producía unha diminución na cantidade de plastoquinonas fotoactivas e un cambio nas proporcións de oxidación e redución de plastoquinona. Suxeriuse que un cambio termoinducido do estado redox da plastoquinona e unha redistribución das súas moléculas entre estados fotoactivos e non fotoactivos son os mecanismos que reflicten e regulan a resposta do aparato fotosintético baixo condicións de estrés por calor.
A plastoquinona identificouse tamén como un cofactor que participa na biosíntese de carotenoides. Ademais, o seu estado redox exerce o papel de sensor redox máis importante dos cloroplastos, xa que inicia moitas das respostas fisiolóxicas aos cambios no medio ambiente, especialmente aqueles que están relacionados coa calidade e a intensidade daa luz. O estado redox da plastoquinona regula tamén a fosforilación dos complexos antena por medio da activación do complexo do citocromo b6f.
Tamén se sabe que a plastoquinona (segundo o seu estado redox) desenvolve un papel na regulación da expresión de xenes fotosintéticos. Nestes experimentos, os fotosistemas eran excitados selectivamente con luz de diferentes lonxitudes de onda ou aplicábanse inhibidores específicos da cadea fotosintética de transporte de electróns. A utilización da luz para excitar selectivamente o fotosistema II producía unha redución da plastoquinona, entanto que a luz que excitaba preferentmente o fotosistema I potenciaba a súa oxidación. Os inhibidores específicos tamén cambian a relación PQ/PQH2: a 3-(3',4'-diclorofenil)-1,1-dimetilurea (DCMU) bloquea a redución da PQ no fotosistema II, e a 2,5-dibromo-3-metil-6-isopropil-p-benzoquinona (DBMIB) bloquea a oxidación da PQH2 por parte do complexo citocromo b6f. Este tipo de experimentos demostran que a oxidación da plastoquinona induce a expresión do xene psbA que codifica a síntese de péptidos presentes no núcleo do fotosistema II e reprimen a expresión do xene psaAB, que codifica a síntese dos péptidos presentes no núcleo do fotosistema I, o cal potencia a síntese de fotosistema II. Por outra parte, a redución da plastoquinona induce a expresión do xene psaAB, que incrementa o nivel de fotosistema I. Estes datos levaron aos autores dos experimentos á conclusión de que se reteñen algúns xenes no xenoma do cloroplasto, porque son regulados directamente polo estado redox da parella PQ/PQH2.
Derivados de uso terapéutico
[editar | editar a fonte]Algúns derivados da plastoquinona deseñados para penetrar nas membranas celulares, como o SkQ1 (plastoquinonil-decil-trifenilfosfonio), o SkQR1 (o análogo do SkQ que contén rhodamina), e o SkQ3, teñen actividade antioxidante e protonófora.[15] [16] O SkQ1 propúxose como molécula para tratar o envellecemento.[17] [18] Co SkQ1 están facéndose ensaios clínicos en Rusia para tratar o glaucoma.
Notas
[editar | editar a fonte]- ↑ Definición de plastoquinona no Dicionario de Galego de Ir Indo e a Xunta de Galicia.
- ↑ PubChem compound
- ↑ http://dictionary.reference.com/browse/Plastoquinone Definition of plastoquinone
- ↑ F.L. Crane, Discovery of plastoquinones: a personal perspective, Photosynthesis Research. 103 (2010), páxinas 195–209. PMID 20217233. [1]
- ↑ B. Ke, Photosynthesis: Photobiochemistry and Photobiophysics, Advances of Photosynthesis, Vol. 10, Kluwer Academic Publishers, Dordrecht, 2001. [2]
- ↑ H.K. Lichtenthaler, Regulation of prenylquinone synthesis in higher plants, en: M. Tevini, H.K. Lichtenthaler (Eds.), Lipids and Lipid Polymers in Higher Plants, Springer, Berlin, 1977, páxinas 231–258 [3]
- ↑ C. Etman-Gervais, C. Tendille, J. Polonsky, 3-demethylplastoquinone-9 et 3-demethylplastoquinone-8 isolees des bulbes d'Iris hollandica, New Journal of Chemistry. 1 (1977), 323–325.
- ↑ R. Barr, M.D. Henninger, F.L. Crane, Comparative studies on plastoquinone. II. Analysis of plastoquinones A, B, C and D, Plant Physiology. 42 (1967) 1246–1254.
- ↑ A. Guskov, J. Kern, A. Gabdulkhakov, M. Broser, A. Zouni, W. Saenger, Cyanobacterial photosystem II at 2.9 Å resolution and the role of quinones, lipids, channels and chloride, Nature Structural and Molecular Biology, 16 (2009) 334–342.
- ↑ Günter A. Peschek. Bioenergetic Processes of Cyanobacteria. Chapter 9.6.2. [4]
- ↑ J. Kruk, K. Strzałka, Dark reoxidation of the PQ-pool proceeds via the low- potential form of cytochrome b-559 in spinach thylakoids, Photosynthesis Research, 62 (1999) 273–279.
- ↑ P. Carol, M. Kuntz, A plastid terminal oxidase comes to light: implications for carotenoids biosynthesis and respiration, Trends in Plant Science, 6 (2001) 31–36.
- ↑ P.A. Millner, J. Barber, Plastoquinone as a mobile redox carrier in the photosynthetic membrane, FEBS Letters, 169 (1984) 1–6. J. Kruk, Charge–transfer complexes of plastoquinone and -tocopherol quinone in vitro, Biophys. Chem. 30 (1988) 143–149.
- ↑ J. Kruk, K. Strzał ka, R.M. Leblanc, Monolayer study of plastoquinones, -tocopherolquinone, their hydroquinone forms and their interaction with monogalactosyldiacylglycerol. Charge–transfer complexes in a mixed monolayer, Biochimica et Biophysica Acta, 1112 (1992) 19–26.
- ↑ "Penetrating cation/fatty acid anion pair as a mitochondria-targeted protonophore.". 2009. Arquivado dende o orixinal o 23 de xaneiro de 2013. Consultado o 11 de maio de 2012.
- ↑ "Penetrating cation/fatty acid anion pair as a mitochondria-targeted protonophore.". 2009. PMC 2818959.
- ↑ "An attempt to prevent senescence: A mitochondrial approach.". 2008. Arquivado dende o orixinal o 30 de setembro de 2010. Consultado o 11 de maio de 2012.
- ↑ http://protein.bio.msu.ru/biokhimiya/contents/v73/pdf/bcm_1329.pdf Mitochondria-Targeted Plastoquinone Derivatives as Tools to Interrupt Execution of the Aging Program. 5. SkQ1 Prolongs Lifespan and Prevents Development of Traits of Senescence. Anisimov etal. 2008
- Berg, J; Tymoczko, J; Stryer, L (2002). W H Freeman and Company, ed. Biochemistry (Fifth Edition). ISBN 0716746840.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Plastoquinones Historia, espectros de absorción, e análogos. (en inglés)