Polifosfato
Un polifosfato é un sal ou éster de oxianións poliméricos formados a partir de unidades estruturais tetraédricas de PO4 (fosfato) enlazadas entre si ao compartiren átomos de oxíxeno. Os polifosfatos poden adoptar estruturas liñais ou cíclicas (aneis). En bioloxía, os ésteres polifosfatos ADP e ATP interveñen no almacenamento e cesión de enerxía. Unha variedade de polifosfatos teñen aplicacións no secuestro de minerais nas augas da traída, xeralmente a concentracións de 1 to 5 ppm.[1] O GTP, CTP e UTP son tamén nucleósidos trifosfato importantes na síntese de proteínas, de lípidos e no metabolismo de carbohidratos, respectivamente.
Os polifosftos tamén se usan como aditivos alimentarios, co número E E452.
Estrutura
[editar | editar a fonte]-
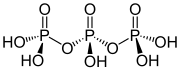
Estrutura do ácido trifosfórico
-
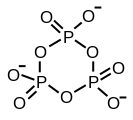
Trimetafosfato cíclico
-
Adenosín difosfato (ADP)
A estrutura do ácido tripolifosfórico ilustra as características que definen a estrutura dos polifosfatos. Consiste en tres unidades tetraédricas de PO4 enlazadas compartindo centos de oxíxeno. Para as cadeas liñais, os grupos fósforo terminais comparten un óxido e os outros centros de fósforo comparten dous centros de óxido. Os fosfatos correspondentes están relacionados con ácidos pola perda de protóns ácidos. No caso do trímero cíclico, cada tetraedro comparte dous vértices cos tetraedros veciños.
Tamén é posible compartir tres vértices. Un polímero liñal pode formar enlaces reticulados. Os polifosfatos con este tipo de enlaces adoptan unha estrutura laminar similar á dos filosilicatos, pero ditas estruturas só se orixinan en condicións extremas.
Formación e síntese
[editar | editar a fonte]Os polifosfatos orixínanse por polimerización de derivados do ácido fosfórico. O proceso empeza cando dúas unidades de fosfato se unen por medio dunha reacción de condensación.
- 2 H(PO4)2− ⇌ (P2O7)4− + H2O
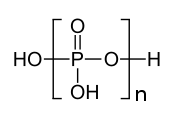
A condensación móstrase como un equilibrio porque a reacción inversa, a hidrólise, tamén é posible. O proceso pode continuar en varias etapas; en cada paso engádese outra unidade de (PO3)− á cadea, como se indica na parte entre corchetes da ilustración do ácido polifosfórico. O P4O10 é o produto final das reaccións de condensación, nas cales cada tetraedro comparte tres vértices cos outros. Inversamente, prodúcese unha mestura complexa de polímeros cando se engade unha pequena cantidade de auga ao pentóxido de fósforo.
Propiedades ácido-base e complexación
[editar | editar a fonte]Os polifosfatos son bases débiles. Un par solitario de electróns nun átomo de oxíxeno pode doarse a un ión hidróxeno (protón) ou a un ión metálico nunha interacción típica ácido de Lewis-base de Lewis. Isto ten un profundo significado en bioloxía. Por exemplo, o adenosín trifosfato está protonado nun 25 % en solución acuosa a pH 7.[2]
- ATP4− + H+ ⇌ ATPH3−, pKa 6,6
Ocorre unha maior protonación a valores menores de pH.
O enlace fosfato de "alta enerxía"
[editar | editar a fonte]O ATP forma complexos quelados con metais iónicos. A constante de estabilidade para o equilibrio
- ATP4− + Mg2+ ⇌ MgATP2−, log β 4
é especialmente grande.[3] A formación do complexo co magnesio é un elemento crítico no proceso de hidrólise do ATP, xa que debilita o enlace entre o grupo fosfato terminal e o resto da molécula.[2][4]
A enerxía liberada na hidrólise do ATP,
- ATP4− + H2O → ADP3− + Pi−
a ΔG -36,8 kJ·mol−1 é grande para o estándares biolóxicos. Pi significa fosfato inorgánico, que está protonado a pH biolóxico. Porén, non é grande para os estándares da química inorgánica.
En realidade, hai que salientar que o termo enlace de 'alta enerxía' referido aos enlaces destes fosfatos é un pouco equívoco, porque o cambio de enerxía libre negativo non se debe directamente á rotura destes enlaces senón a toda a reacción química no seu conxunto. A rotura destes enlaces, como a rotura da maioría dos enlaces, é endergónica e consome enerxía en lugar de liberala. O que ocorre é que o cambio de enerxía libre negativo débese a que os enlaces que se forman despois da hidrólise (ou a fosforilación dun residuo polo ATP) son inferiores en enerxía aos enlaces que estaban presentes antes da hidrólise. (Isto inclúe todos os enlaces implicados na reacción, non só os enlaces dos fosfatos). Este efecto débese a diversos factores incluíndo unha estabilización de resonancia e a solvatación dos produtos en relación cos reactivos.
Polifosfatos inorgánicos altamente poliméricos
[editar | editar a fonte]Existen polifosfatos de alto peso molecular.[5] Un derivado é o sal de Graham vítreo (amorfo). Entre os polifosfatos cristalinos de alto peso molecular están o sal de Kurrol e o sal de Maddrell (un po branco practicamente insoluble en auga). Estas especies teñen a fórmula [NaPO3]n[NaPO3(OH)]2, onde n pode ser de ata 2000. En canto ás súas estruturas, estes polímeros constan de "monómeros" de PO3−, coas cadeas terminadas en fosfatos protonados.[6]
Na natureza
[editar | editar a fonte]Os polifosfatos inorgánicos altamente poliméricos atopounos nos seres vivos L. Liberman en 1890. Estes compostos son polímeros liñais que conteñen desde só uns poucos ata varios centos de residuos de ortofosfato ligados por enlaces fosfoanhidrido ricos en enerxía.
Previamente, os polifosfatos eran considerados un “fósil molecular” ou só unha fonte de fósforo e enerxía que servía para a supervivencia de microorganimsos en condicións extremas. Estes compostos teñen funcións regulatorias e aparecen en todos os reinos de seres vivos, participando no axuste metabólico a nivel xenético e encimático. O polifosfato está implicado directamente no cambio do programa xenético característico dun estadio de crecemento exponencial de bacterias ao programa de supervivencia da célula en condicións estacionarias, o que se chamou "unha vida no carril lento". Participan en moitos mecanismos regulatorios que se dan nas bacterias, como son:
- Participan na indución de rpoS, unha subunidade da ARN polimerase que é responsable da expresión dun gran número de xenes implicados no axuste da fase de crecemento estacionario e na de moitos axentes estresantes.
- Son importantes para a motilidade celular, formación de biopelículas e a virulencia.[Cómpre clarificar]
- Os polifosfatos e as exopolifosfatases participan na regulación dos niveis do factor de resposta estrito, o guanosín 5'-difosfato 3'-difosfato (ppGpp), un segundo mensaxeiro que funciona en células bacterianas.
- Os polifosfatos participan na formación de canles nas membranas celulares. As canles formadas por polifosfato e poli-beta-hidroxibutirato con Ca2+ están implicadas en procesos de transporte en diversos organismos.
- Unha importante función do polifosfato en microorganismos —procariotas e eucariotas inferiores— é a de afrontar os cambios nas condicións ambientais ao proporcionaren reservas de fosfato e enerxía. Os polifosfatos están presentes nas células animais, e hai moitos datos da súa participación en procesos regulatorios durante o desenvolvemento, proliferación e diferenciación celulares, especialmente no tecido óseo e o cerebro.
En humanos os polifosfatos xogan un papel clave na coagulación do sangue. Producidos e liberados polas plaquetas[7] activan o factor XII de coagulación, que é esencial para a formación do coágulo. O factor XII, tamén chamado factor de Hageman, inicia a formación de fibrina e a xeración dun mediador proinflamatorio chamado bradicinina, que contribúe á permeabilidade vascular e a trombose.[8][9] Os polifosfatos derivados de bacterias alteran a resposta inmunitaria do hóspede durante a infección e atacar os polifosfatos con exopolifosfatase recombinante mellora a supervivencia á sepse en ratos.[10] Os polifosfatos inorgánicos xogan un papel crucial na tolerancia das células de lévedo a catións de metais pesados tóxicos.[11]
Uso como aditivo alimentario
[editar | editar a fonte]O polifosfato de sodio (E452(i)), o polifosfato de potasio (E452(ii)), o polifosfato de calcio e sodio (E452(iii)) e o polifosfato de calcio (E452(iv)) utilízanse como aditivos alimentarios (emulsificadores, humectantes, secuestrantes, estabilizadores e espesantes).[12] Polo que se sabe non supoñen ningúnn risco potencial para a saúde á parte do risco xeralmente atribuído a outras fontes de fosfato (incluíndo as que están presentes de forma natural nos alimentos). Aínda que se expresou algunha preocupación sobre os efectos prexudiciais sobre os ósos e as doenzas cardiovasculares, así como sobre a hiperfosfatemia, estas parecen ser relevantes soamente cun consumo esaxerado de fontes de fosfato. En conxunto, o consumo responsable (ata 40 mg de fosfato por kg e peso corporal por día) parece non supoñer ningún risco para a saúde.[13][14]
Notas
[editar | editar a fonte]- ↑ Jessen, Henning J.; Dürr-Mayer, Tobias; Haa, Thomas M.; Ripp, Alexander; Cummins, Christopher C. (2021). "Lost in Condensation: Poly-, Cyclo-, and Ultraphosphates". Accounts of Chemical Research 54 (21): 4036–4050. PMID 34648267. doi:10.1021/acs.accounts.1c00370.
- ↑ 2,0 2,1 Storer A, Cornish-Bowden A (1976). "Concentration of MgATP2- and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions". Biochem J 159 (1): 1–5. PMC 1164030. PMID 11772. doi:10.1042/bj1590001.
- ↑ Wilson J, Chin A (1991). "Chelation of divalent cations by ATP, studied by titration calorimetry". Anal Biochem 193 (1): 16–9. PMID 1645933. doi:10.1016/0003-2697(91)90036-S.
- ↑ Garfinkel L, Altschuld R, Garfinkel D (1986). "Magnesium in cardiac energy metabolism". J Mol Cell Cardiol 18 (10): 1003–13. PMID 3537318. doi:10.1016/S0022-2828(86)80289-9.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2ª ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann’s Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. doi 10.1002/14356007.a19_465.pub3
- ↑ Ruiz FA, Lea CR, Oldfield E, Docampo R (outubro de 2004). "Human platelet dense granules contain polyphosphate and are similar to acidocalcisomes of bacteria and unicellular eukaryotes". J Biol Chem 279 (43): 44250–7. PMID 15308650. doi:10.1074/jbc.M406261200.
- ↑ Müller F, Mutch NJ, Schenk WA, Smith SA, Esterl L, Spronk HM, Schmidbauer S, Gahl WA, Morrissey JH, Renné T (decembro de 2009). "Platelet polyphosphates are proinflammatory and procoagulant mediators in vivo". Cell 139 (6): 1143–56. PMC 2796262. PMID 20005807. doi:10.1016/j.cell.2009.11.001.
- ↑ "Newly discovered mechanism by which blood clots form". physorg.com. 10 de decembro de 2009. Consultado o 13 de decembro de 2009.
- ↑ Roewe J, Stavrides G, Strueve M, Sharma A, Marini F, Mann A, Smith SA, Kaya Z, Strobl B, Mueller M, Reinhardt C, Morrissey JH, Bosmann M (agosto de 2020). "Bacterial polyphosphates interfere with the innate host defense to infection". Nature Communications 11 (1): 4035. Bibcode:2020NatCo..11.4035R. PMC 7423913. PMID 32788578. doi:10.1038/s41467-020-17639-x.
- ↑ Andreeva N, Ryazanova L, Dmitriev V, Kulakovskaya T, Kulaev I (agosto de 2013). "Adaptation of Saccharomyces cerevisiae to toxic manganese concentration triggers changes in inorganic polyphosphates.". FEMS Yeast Res 13 (5): 463–470. PMID 23663411. doi:10.1111/1567-1364.12049.
- ↑ "E452 Polyphosphates". openfoodfacts.org. Consultado o 2022-03-18.
- ↑ EFSA Panel on Food Additives and Flavourings (FAF), Younes, M., Aquilina, G., Castle, L., Engel, K. H., Fowler, P., ... & Mennes, W. (2019). Re‐evaluation of phosphoric acid–phosphates–di‐, tri‐and polyphosphates (E 338–341, E 343, E 450–452) as food additives and the safety of proposed extension of use. EFSA Journal, 17(6), e05674.
- ↑ Ritz, E., Hahn, K., Ketteler, M., Kuhlmann, M. K., & Mann, J. (2012). Phosphate additives in food—a health risk. Deutsches Ärzteblatt International, 109(4), 49.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Pavlov E, Grimbly C, Diao CT, French RJ (setembro de 2005). "A high-conductance mode of a poly-3-hydroxybutyrate/calcium/polyphosphate channel isolated from competent Escherichia coli cells". FEBS Lett. 579 (23): 5187–92. Bibcode:2005FEBSL.579.5187P. PMID 16150446. doi:10.1016/j.febslet.2005.08.032.
- Kulaev I, Vagabov V, Kulakovskaya T (1999). "New aspects of inorganic polyphosphate metabolism and function". J. Biosci. Bioeng. 88 (2): 111–29. PMID 16232585. doi:10.1016/S1389-1723(99)80189-3.
- Kulaev I, Kulakovskaya T (2000). "Polyphosphate and phosphate pump". Annu. Rev. Microbiol. 54: 709–34. PMID 11018142. doi:10.1146/annurev.micro.54.1.709.