Ponte salina (proteínas e supramolecular)

En química de proteínas e supramolecular, unha ponte salina é unha combinación de dúas interaccións non covalentes: un enlace de hidróxeno e un enlace iónico (Figura 1). Isto obsérvase principalmente nas proteínas, nas que contribúe á estabilidade dunha conformación de pregamento entropicamente desfavorable. Aínda que as interaccións non covalentes son relativamente débiles, pequenas interaccións estabilizantes poden sumar os seus efectos e supoñer unha importante contribución á estabilidade global dun confórmero.[1] As pontes salinas non se encontran só en proteínas, senón que poden tamén encontrarse en quimica supramolecular. A termodinámica de cada un dos casos pode investigarse por procedementos experimentais para avaliar a contribución da ponte salina á enerxía libre global do estado.
Pontes salinas en proteínas
[editar | editar a fonte]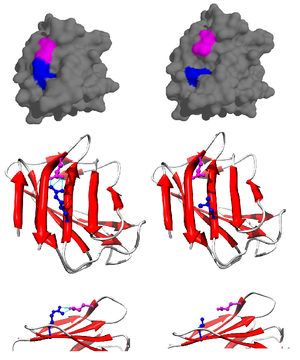
A ponte salina a miúdo orixínase a partir do carboxilato aniónico (RCOO−) do ácido aspártico ou ácido glutámico e o amonio catiónico (RNH3+) a partir da lisina ou o guanidinio (RNHC(NH2)2+) da arxinina (Figura 2).[1] Aínda que estes son os máis comúns, outros residuos con cadea lateral ionizable como a histidina, tirosina e serina poden tamén participar, dependendo de factores exteriores que alteran o seu pKa. A distancia entre os residuos que participan na ponte salina é tamén citado como importante. A distancia requirida é menor de 4 Å (400 pm). Os aminoácidos situados a unha distancia maior non poden formar unha ponte salina.[3] Debido ás numerosas cadeas laterais ionizables de aminoácidos que se encontran por toda a proteína, o pH no cal a proteína se sitúa é crucial para a súa estabilidade.
Métodos para cuantificar a estabilidade das pontes salinas
[editar | editar a fonte]
A contribución dunha ponte salina á estabilidade global do estado pregado dunha proteína pode estimarse por medio de datos termodinámicos obtidos en estudos de mutaxénese e técnicas de resonancia magnética nuclear.[4] Usando unha proteína mutada de tipo pseudosilvestre que foi especificamente mutada para impedir a súa precipitación a altos pH, a contribución da ponte salina á enerxía libre global do estado pregado da proteína pode determinarse realizando unha mutación puntual, que altera e, en consecuencia, rompe a ponte salina. Por exemplo, identificouse unha ponte salina no lisozima T4 entre o ácido aspártico (Asp) no residuo 70 e unha histidina (His) no residuo 31 (Figura 3). Fíxose unha mutaxénese dirixida a sitio con asparaxina (Asn) (Figura 4) obtendo tres novos mutantes: Asp70Asn His31 (Mutante 1), Asp70 His31Asn (Mutante 2), e Asp70Asn His31Asn (Dobre Mutante).

Unha vez que se estableceron os mutantes, poden empregarse dous métodos para calcular a enerxía libre asociada cunha ponte salina. Un método implica a observación da temperatura de fusión do tipo salvaxe fronte á dos tres mutantes. A desnaturalización pode ser monitorizada por medio do cambio no dicroísmo circular. Unha redución na temperatura de fusión indica unha redución na estabilidade. Isto está cuantificado por un método descrito por Becktel e Schellman, no que a diferenza de enerxía libre entre os dous é calculada por medio de ΔTΔS.[5] No exemplo do lisozima T4, o ΔS do tipo pseudosilvestre fora previamente obtido a pH 5,5, polo que a diferenza de temperatura no punto medio de 11 °C a ese pH multiplicada polo ΔS obtido de 360 cal/(mol·K) (1,5 kJ/(mol·K)) dá un cambio de enerxía libre duns −4 kcal/mol (−17 kJ/mol). Este valor corresponde á cantidade de enerxía libre coa que a ponte salina contribúe á estabilidade da proteína.

O segundo método utiliza espectroscopia de resonancia magnética nuclear para calcular a enerxía libre da ponte salina. Realízase unha titración ou titulación, mentres se rexistra o cambio químico correspondente aos protóns do carbono adxacente ao grupo carboxilato ou grupo amonio. O punto medio da curva de titración corresponde ao pKa, ou o pH no que a proporción de moléculas protonadas:desprotonadas é 1:1. Continuando co exemplo do lisozima T4, obtense unha curva de titración pola observación dun cambio no protón C2 da histidina 31 (Figura 5). A Figura 5 mostra o cambio na curva de tritración entre o tipo silvestre e o mutante no cal o Asp70 é Asn. A ponte salina formada está entre o Asp70 desprotonado e a His31 protonada. Esta interacción causa o cambio observado no pKa da His31. Na proteína de tipo silvestre non pregada, na que non hai ponte salina, a His31 ten un pKa de 6,8 en tampóns de H2O de forza iónica moderada. A Figura 5 mostra un pKa do tipo silvestre de 9,05. Esta diferenza no pKa débese á interacción da His31 co Asp70. Para que se manteña a ponte salina, a His31 terá que reter o seu protón tanto como sexa posible. Cando se altera a ponte salina, como ocorre no mutante D70N, o pKa baixa ao valor 6,9, moito máis próximo ao da His31 no estado non pregado.
A diferenza en pKa pode cuantificarse para reflectir a contribución da ponte salina á enerxía libre. Usando a enerxía libre de Gibbs: ΔG = −RT ln(Keq), onde R é a constante universal dos gases, T é a temperatura en kelvins, e Keq é a constante de equilibrio dunha reacción en equilibrio. A desprotonación da His31 é unha reacción de equilibrio de ácido cunha Keq especial coñecida como constante de disociación de ácido, Ka:
His31-H+ ⇌ His31 + H+.
O pKa é despois relacionado coa Ka da seguinte maneira: pKa = −log(Ka). A diferenza do cálculo da enerxía libre do mutante e o tipo silvestre pode agora facerse usando a ecuación de enerxía libre, a definición de pKa, os valores de pKa observados, e a relación entre os logaritmos naturais (neperianos) e os logaritmos de base 10. No exemplo do lisozima T4, isto dá unha contribución calculada duns 3 kcal/mol á enerxía libre global.[4] Pode utilizarse un procedemento similar cos outros participantes na ponte salina, como o Asp70 no exemplo do lisozima T4, monitorizando o seu cambio no pKa despois da mutación de His31.
Debe terse coidado ao elixir o experimento axeitado coa localización da ponte salina na proteína. O ambiente xoga un importante papel na interacción.[6] A altas forzas iónicas, a ponte salina pode quedar completamente enmascarada se está implicada unha interacción electrostática. A ponte salina His31-Asp70 no lisozima T4 está enterrada no interior da proteína. A entropía é moi importante nas pontes salinas de superficie, nas que os residuos que normalmente teñen a capacidade de moverse están restrinxidos pola súa interacción electrostática e pontes de hidróxeno. Isto diminúe a entropía dabondo como para que case borre a contribución da interacción.[7] As pontes salinas de superficie poden ser estudadas de maneira similar á das pontes salinas enterradas, empregando ciclos de dobres mutantes e titracións RMN.[8] Aínda que existen casos nos que as pontes salinas enterradas contribúen á estabilidade, hai tamén excepcións nas que as pontes salinas enterradas poden mostrar un efecto desestabilizador.[3] Ademais as pontes salinas superficiais, en certas condicións, poden mostrar un efecto estabilizador.[6][8] O efecto estabilizante ou desestabilizante debe ser avaliado caso por caso e non se poden facer afirmacións xerais.
Química supramolecular
[editar | editar a fonte]

A química supramolecular trata das interaccións non covalentes entre macromoléculas. As pontes salinas foron utilizadas neste campo de xeitos diversos e creativos, como a síntese de cápsulas moleculares e polímeros de dobre hélice.
Cápsulas moleculares
[editar | editar a fonte]As cápsulas moleculares son armazóns químicos deseñados para capturar e reter unha molécula hóspede (encapsulación molecular). Szumna e colaboradores desenvolveron unha nova cápsula molecular cun interior quiral.[9] Esta cápsula está constituída por dúas metades, como un ovo de Páscua de plástico (Figura 6). As interaccións das pontes salinas entre as dúas metades causan que estas se autoensamblen en solución (Figura 7). Son estables incluso cando se quentan a 60 °C.
Polímeros de dobre hélice
[editar | editar a fonte]Yashima e colaboradores utilizaron pontes salinas para construír varios polímeros que adoptan unha conformación en dobre hélice similar ao ADN.[10] Nun exemplo, incorporaron platino para crear un metalopolímero de dobre hélice.[11] Empezando cos seus monómeros e platino(II) bifenilo (Figura 8), os seus metalopolímeros autoensambláronse por medio dunha serie de reaccións de intercambio de ligando. As dúas metades do monómero están ancoradas por medio da ponte salina entre o carboxilato desprotonado e os nitróxenos protonados.

Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Dougherty, Dennis A. (2006). Modern Physical Organic Chemistry. Sausalito, CA: University Science Books. ISBN 1-891389-31-9.
- ↑ Al-Haggar M; Madej-Pilarczyk A; Kozlowski L; Bujnicki JM; Yahia S; Abdel-Hadi D; Shams A; Ahmad N; Hamed S; Puzianowska-Kuznicka M (2012). "A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome.". Eur J Hum Genet 20 (11): 1134–40. PMC 3476705. PMID 22549407. doi:10.1038/ejhg.2012.77.
- ↑ 3,0 3,1 Kumar, S.; Nussinov, R. (2002). "Close-Range Electrostatic Interactions in Proteins". ChemBioChem 3 (7): 604–617. PMID 12324994. doi:10.1002/1439-7633(20020703)3:7<604::AID-CBIC604>3.0.CO;2-X.
- ↑ 4,0 4,1 Anderson, D. E.; Becktel, W. J.; Dahlquist, F. W. (1990). "pH-Induced Denaturation of Proteins: A Single Salt Bridge Contributes 3-5 kcal/mol to the Free Energy of Folding of T4 Lysozyme". Biochemistry 29 (9): 2403–2408. PMID 2337607. doi:10.1021/bi00461a025.
- ↑ Becktel, W.J.; Schellman, J.A. (1987). "Protein stability curves". Biopolymers 26 (11): 1859–1877. PMID 3689874. doi:10.1002/bip.360261104.
- ↑ 6,0 6,1 Horovitz, A.; Serrano, L.; Avron, B.; Bycroft, M.; Fersht, A.R. (1990). "Strength and Co-operativity of Contributions of Surface Salt Bridges to Protein Stability". J. Mol. Biol. 216 (4): 1031–1044. PMID 2266554. doi:10.1016/S0022-2836(99)80018-7.
- ↑ Dao-pin, S.; Sauer, U.; Nicholson, H.; Mathews, B. W. (1991). "Contributions of Engineered Surface Salt Bridges to the Stability of T4 Lysozyme Determined by Directed Mutagenesis". Biochemistry 30 (29): 7142–7153. PMID 1854726. doi:10.1021/bi00243a015.
- ↑ 8,0 8,1 Strop, P.; Mayo, S. L. (2000). "Contribution of Surface Salt Bridges to Protein Stability". Biochemistry 39 (6): 1251–1255. doi:10.1021/bi992257j.
- ↑ Kuberski, B.; Szumna, A. (2009). "A Self-Assembled Chiral Capsule with Polar Interior". Chem. Commun. 15 (15): 1959–1961. doi:10.1039/b820990a.
- ↑ Liu, J.; Lam, J. W. Y.; Tang, B. Z. (2009). "Acetylenic Polymers: Syntheses, Structures, and Functions". Chem. Rev. 109 (11): 5799–5867. PMID 19678641. doi:10.1021/cr900149d.
- ↑ Ikeda, M.; Tanaka, Y.; Hasegawa, T.; Yashima, E. J.; Yashima, Eiji (2006). "Construction of Double-Stranded Metallosupramolecular Polymers with a Controlled Helicity by Combination of Salt Bridges and Metal Coordination". J. Am. Chem. Soc. 128 (21): 6806–6807. PMID 16719458. doi:10.1021/ja0619096.