Produto final da glicación avanzada
Os produtos finais da glicación avanzada ou PFGAs (na literatura inglesa AGEs ou advanced glycation end-products) son proteínas ou lípidos que quedan glicados como resultado da exposición a azucres.[1] Son biomarcadores implicados no envellecemento e no desenvolvemento ou empeoramento de moitas doenzas dexenerativas, como a diabetes, aterosclerose, enfermidade renal crónica e enfermidade de Alzheimer.[2]
Fontes dietarias
[editar | editar a fonte]Os alimentos de orixe animal que son ricos en graxas e proteínas son xeralmente ricos en PFGA e tenden a formar cantidades adicionais de PFGA durante a súa preparación culinaria.[3] Porén, só os PFGA de baixo peso molecular son absorbidos dos alimentos da dieta, e, de feito, os vexetarianos teñen maiores concentracións totais de PFGA en comparación cos non vexetarianos.[4] Polo tanto, non está claro se os PFGA da dieta contribúen a enfermidades ou ao envellecemento, ou se só os PFGA endóxenos (os producidos dentro do corpo) teñen importancia.[5] Isto non significa que a dieta non poida ter unha influencia potencialmente negativa sobre os PFGA, senón que implica que se lles pode prestar menos atención aos PFGA contidos na dieta que a outros aspectos da dieta que orixinan niveis elevados de azucre no sangue e formación de PFGAs endóxenos[4][5] Como os PFGAs están relacionados con niveis de azucre elevados, unha dieta baixa en calorías pode reducir a súa cantidade.[6]
Efectos
[editar | editar a fonte]
Os PFGA afectan a case todo tipo de células e moléculas do corpo e pénsase que son un factor no envellecemento[7] e nalgunhas doenzas crónicas relacionadas coa idade.[8][9][10] Tamén se cre que teñen un papel na causa das complicacións vasculares da diabetes mellitus.[11]
Os PFGA orixínanse en certas condicións patolóxicas, como o estrés oxidativo debido á hiperglicemia en pacientes de diabetes.[12] Os PFGA teñen tamén un papel como mediadores inflamatorios na diabetes xestacional.[13]
No contexto das doenzas cardiovasculares, os PFGA poden inducir a formación de enlaces cruzados no coláxeno, o cal pode causar un endurecemento dos vasos sanguíneos e o atrapamento de partículas de lipoproteína de baixa densidade (LDL) nas paredes arteriais. Os PFGA poden tamén causar a glicación das LDL, o cal pode promover a súa oxidación.[14] As LDL oxidadas son un dos principais factores no desenvolvemento de aterosclerose.[15] Finalmente, os PFGA poden unirse a un RAGE (receptor para produtos finais da glicación avanzada) e causar estrés oxidativo, así como a activación de vías inflamatorias en células endoteliais vasculares.[14][15]
Noutras doenzas
[editar | editar a fonte]Os PFGA foron implicados na enfermidade de Alzheimer,[16] doenzas cardiovasculares,[17] e accidentes cerebrovasculares.[18] O mecanismo polo cal os PFGAs inducen danos é por medio dun proceso chamado formación de enlaces cruzados (reticulación) que causa danos intracelulares e apoptose.[19] Forman fotosensibilizadores no cristalino do ollo,[20] o cal ten importancia para o desenvolvemento de cataratas.[21] A redución da función muscular tamén está asociada cos PFGAs.[22]
Patoloxía
[editar | editar a fonte]Os PFGAs teñen diversos efectos patolóxicos, como:[23][24]
- Incremento da permeabilidade vascular.
- Incremento da rixidez arterial
- Inhibición da vasodilatación ao interferiren co óxido nítrico.
- Oxidación das LDL.
- Unión a células, incluíndo macrófagos, células endoteliais e células mesanxiais, para inducir a secreción de varias citocinas.
- Aumento do estrés oxidativo.
- Elevación dos niveis de hemoglobina-PFGA en persoas diabéticas[25] e outras proteínas PFGA que en modelos experimentais se viu que se acumulaban co tempo, incrementándose ata 5-50 veces máis en períodos de 5–20 semanas na retina, cristalino e córtex renal de ratas diabéticas. A inhibición da formación de PFGAs reducía o grao de nefropatía en ratas diabéticas.[26] Polo tanto, as substancias que inhiben a formación de PFGAs poden limitar a progresión de enfermidades e poden ofecer novas ferramentas para intervencións terapéuticas no tratamento de doenzas mediadas polos PFGAs.[27][28]
- Os PFGA teñen receptores celulares específicos; os mellor caracterizados son os chamados RAGE. A activación dos RAGE celulares no endotelio, fagocitos mononucleares, e linfocito desencadea a xeración de radicais libres} e a expresión de mediadores de xenes inflamatorios.[29] Tal incremento no estrés oxidativo leva á activación do factor de transcrición NF-κB e promove a expresión de xenes regulados por NF-κB que foron asociados coa aterosclerose.[27]
Reactividade
[editar | editar a fonte]As proteínas adoitan glicarse nos seus residuos de lisina.[30] En humanos, as histonas do núcleo celular son ricas en lisina, e, polo tanto, forman a proteína glicada N(6)-carboximetillisina (CML).[30]
Un receptor denominado RAGE, do inglés receptor for advanced glycation end products, atópase en moitas células, como as células endoteliais, músculo liso, células do sistema inmunitario de tecidos como o pulmón, fígado e riles. Este receptor, cando se unen a el os PFGAs, contribúe ás enfermidades inflamatorias crónicas relacionadas coa idade e a diabetes, como a aterosclerose, asma, artrite, infarto de miocardio, nefropatía, retinopatía, periodontite e neuropatía.[31] Hipotetízase que a patoxénese deste proceso activa o factor de transcrición nuclear kappa B (NF-κB) despois da unión dos PFGAs.[32] O NF-κB controla varios xenes que están implicados na inflamación.[33] Os PFGAs poden detectarse e cuantificarse usando métodos bioanalíticos e inmunolóxicos.[34]
Eliminación
[editar | editar a fonte]Na eliminación (depuración) ou velocidade á cal unha substancia é eliminada do corpo, atopouse que a proteólise celular dos PFGAs —a degradación de proteínas— produce péptidos PFGA e "adutos libres de PFGAs" (adutos de PFGA unidos a un só aminoácido). Estes posteriormente, unha vez liberados no plasma sanguíneo, poden ser excretados pola urina.[35]
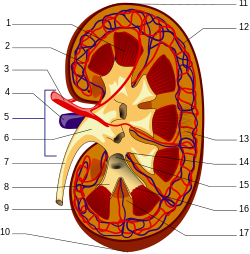
Non obstante, a resistencia das proteínas de matriz extracelular á proteólise fai que os seus produtos finais da glicación avanzada sexan menos propicios a seren eliminados.[35] Mentres que os adutos libres de PFGA se liberan directamente pola urina, os péptidos PFGA son endocitados polas células epiteliais do túbulo proximal e despois degradados polo sistema endolisosómico para producir aminoácidos PFGA. Pénsase que estes ácidos volven despois ao espazo interno dos riles ou lume para a excreción. [23] Os adutos libres de PFGA son a forma principal a través da cal os PFGAs se excretan pola urina, e os péptidos PFGA aparecen en menor grao[23] pero acumúlanse no plasma de pacientes con insuficiencia renal crónica.[35]
As proteínas PFGA derivadas extracelularmente máis grandes non poden pasar pola membrana basal do corpúsculo renal e deben primeiro degradarse a péptidos PFGA e adutos libres de PFGA. Os macrófagos periféricos[23] e as células entoteliais dos sinusoides hepáticos e as células de Kupffer [36] foron implicados neste proceso, aínda que se discutiu a implicación do fígado na vida real. [37]

As proteínas PFGA grandes non poden entrar na cápsula de Bowman pero poden unirse a receptores das células endoteliais e mesanxiais e á matriz mesanxial.[23] A activación de RAGE induce a produción de diversas citocinas, incluíndo o TNFβ, que é mediador nunha inhibición da metaloproteinase e incrementa a produción de matriz mesanxial, o que conduce á glomeruloesclerose[24] e diminúe a función renal en pacientes con niveis de PFGA infrecuentemente altos.
Aínda que son a única forma axeitada para a excreción urinaria, os produtos de degradación de PFGA, é dicir, os péptidos e adutos libres, son máis agresivos que as proteínas PFGA das cales derivan, e poden perpetuar a patoloxía relacionada en pacientes diabéticos, incluso despois de que se conseguiu controlar a hiperglicemia.[23]
Algúns PFGAs teñen unha capacidade oxidativa catalítica innata, mentres que a activación da NAD(P)H oxidase por medio da activación de RAGE e danos nas proteínas mitocondriais orixinando disfunción mitocondrial poden tamén inducir estrés oxidativo. Un estudo de 2007 in vitro atopou que os PFGAs podían incrementar significativamente a expresión de TGF-β1, CTGF, ARNm Fn en células NRK-49F polo aumento do estrés oxidativo, e suxeriu que a inhibición do estrés oxidativo podería explicar o efecto do extracto do Ginkgo biloba na nefropatía diabética. Os autores suxeriron que a terapia antioxidante podería axudar a impedir a acumulación de PFGAs e os danos inducidos.[24] Ao final, é necesaria a eliminación efectiva, e os que sofren incrementos de PFGAs debido á disfunción renal poderían necesitar un transplante de ril.[23]
En diabéticos que teñen un amento da produción de PFGAs, o dano renal reduce a subseguinte eliminación renal dos PFGAs, formando un bucle de retroalimentación positiva que incrementa as danos. Nun estudo de 1997, individuos dibéticos e sans recibiron unha soa comida de clara de ovo (56 g de proteína), cociñada con ou sen 100 g de frutosa; houbo un incremento de 200 veces na inmnorreactividade dos PFGAs coa comida con frutosa.[38]
Posibles terapias
[editar | editar a fonte]
Os PFGAs están sendo moi investigados e algúns estudos están aínda nunha fase inicial. Hai tres estratexias terapéuticas: prevención da formación de PFGAs, romper a reticulación despois de que se formou, e impedir os seus efectos negativos.
Os compostos que se atopou que inhiben a formación de PFGAs no laboratorio son a vitamina C, Agmatine, benfotiamina, piridoxamina, ácido alfa-lipoico,[39][40] taurina,[41] pimagedine,[42] aspirina,[43][44] carnosina,[45] metformina,[46] pioglitazone,[46] e pentoxifilina.[46] A activación do receptor TRPA-1 polo ácido lipoico ou ácido podocárpico reduce os niveis de PFGAs ao aumentar a detoxificación de metilglioxal, un importante precursor de varios PFGAs.[39]
Os estudos en ratos e ratas encontraron que os fenois naturais como o resveratrol e a curcumina poden impedir os efectos negativos dos PFGAs.[47][48]
Os compostos que se pensa que rompen algúns dos enlaces cruzados dos PFGAs son Alagebrium (e os compostos relacionados ALT-462, ALT-486 e ALT-946)[49] e o bromuro de N-fenacil tiazolio.[50] Un estudo in vitro mostrou que o ácido rosmarínico supera o potencial de degradación de PFGAs de ALT-711.[51]

Porén, non hai ningún axente coñecido que poida degradar o PFGA máis común, o glucosepane, que aparece cunha frecuencia de 10 a 1000 veces maior nos tecidos humanos que calquera outro PFGA con enlaces cruzados.[52][53]
Por outra parte, algúns compostos químicos, como a aminoguanidina, poderían limitar a formación de PFGAs ao reaccionaren coa 3-desoxiglicosona.[31]
Notas
[editar | editar a fonte]- ↑ Goldin, Alison; Beckman, Joshua A.; Schmidt, Ann Marie; Creager, Mark A. (2006). "Advanced Glycation End Products Sparking the Development of Diabetic Vascular Injury". Circulation 114 (6): 597–605. PMID 16894049. doi:10.1161/CIRCULATIONAHA.106.621854.
- ↑ Vistoli, G; De Maddis, D; Cipak, A; Zarkovic, N; Carini, M; Aldini, G (Aug 2013). "Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): an overview of their mechanisms of formation." (PDF). Free Radic Res 47: Suppl 1:3–27. PMID 23767955. doi:10.3109/10715762.2013.815348.
- ↑ Uribarri, Jaime; Woodruff, Sandra; Goodman, Susan; Cai, Weijing; Chen, Xue; Pyzik, Renata; Yong, Angie; Striker, Gary E.; Vlassara, Helen (xuño de 2010). "Advanced Glycation End Products in Foods and a Practical Guide to Their Reduction in the Diet". Journal of the American Dietetic Association 110 (6): 911–916.e12. PMC 3704564. PMID 20497781. doi:10.1016/j.jada.2010.03.018.
- ↑ 4,0 4,1 Poulsen, Malene W.; Hedegaard, Rikke V.; Andersen, Jeanette M.; de Courten, Barbora; Bügel, Susanne; Nielsen, John; Skibsted, Leif H.; Dragsted, Lars O. (outubro de 2013). "Advanced glycation endproducts in food and their effects on health". Food and Chemical Toxicology 60: 10–37. PMID 23867544. doi:10.1016/j.fct.2013.06.052.
- ↑ 5,0 5,1 Luevano-Contreras, Claudia; Chapman-Novakofski, Karen (13 de decembro de 2010). "Dietary Advanced Glycation End Products and Aging". Nutrients 2 (12): 1247–1265. PMC 3257625. PMID 22254007. doi:10.3390/nu2121247.
- ↑ Gugliucci, Alejandro; Kotani, Kazuhiko; Taing, Jennifer; Matsuoka, Yukiyo; Sano, Yoshiko; Yoshimura, Makiko; Egawa, Kahori; Horikawa, Chika; Kitagawa, Yoshinori; Kiso, Yoshinobu; Kimura, Satoshi; Sakane, Naoki (2009). "Short-Term Low Calorie Diet Intervention Reduces Serum Advanced Glycation End Products in Healthy Overweight or Obese Adults". Annals of Nutrition and Metabolism 54 (3): 197–201. doi:10.1159/000217817.
- ↑ Chaudhuri, Jyotiska; Bains, Yasmin; Guha, Sanjib; Kahn, Arnold; Hall, David; Bose, Neelanjan; Gugliucci, Alejandro; Kapahi, Pankaj (4 de setembro de 2018). "The role of advanced glycation end products in aging and metabolic diseases: bridging association and causality". Cell Metabolism 28 (3): 337–352. PMC 6355252. PMID 30184484. doi:10.1016/j.cmet.2018.08.014.
- ↑ Glenn, J.; Stitt, A. (2009). "The role of advanced glycation end products in retinal ageing and disease". Biochimica et Biophysica Acta (BBA) - General Subjects 1790 (10): 1109–1116. PMID 19409449. doi:10.1016/j.bbagen.2009.04.016.
- ↑ Semba, R. D.; Ferrucci, L.; Sun, K.; Beck, J.; Dalal, M.; Varadhan, R.; Walston, J.; Guralnik, J. M.; Fried, L. P. (2009). "Advanced glycation end products and their circulating receptors predict cardiovascular disease mortality in older community-dwelling women". Aging Clinical and Experimental Research 21 (2): 182–190. PMC 2684987. PMID 19448391. doi:10.1007/BF03325227.
- ↑ Semba, R.; Najjar, S.; Sun, K.; Lakatta, E.; Ferrucci, L. (2009). "Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults". American Journal of Hypertension 22 (1): 74–79. PMC 2637811. PMID 19023277. doi:10.1038/ajh.2008.320.
- ↑ Yan, S. F.; D'Agati, V.; Schmidt, A. M.; Ramasamy, R. (2007). "Receptor for Advanced Glycation Endproducts (RAGE): a formidable force in the pathogenesis of the cardiovascular complications of diabetes & aging". Current Molecular Medicine 7 (8): 699–710. PMID 18331228. doi:10.2174/156652407783220732.
- ↑ Brownlee, M (xuño de 2005). "The pathobiology of diabetic complications: a unifying mechanism.". Diabetes 54 (6): 1615–25. PMID 15919781. doi:10.2337/diabetes.54.6.1615.
- ↑ Pertyńska-Marczewska, Magdalena; Głowacka, Ewa; Sobczak, Małgorzata; Cypryk, Katarzyna; Wilczyński, Jan (11 de xaneiro de 2009). "Glycation Endproducts, Soluble Receptor for Advanced Glycation Endproducts and Cytokines in Diabetic and Non-diabetic Pregnancies". American Journal of Reproductive Immunology 61 (2): 175–182. PMID 19143681. doi:10.1111/j.1600-0897.2008.00679.x.
- ↑ 14,0 14,1 Prasad, Anand; Bekker, Peter; Tsimikas, Sotirios (2012). "Advanced Glycation End Products and Diabetic Cardiovascular Disease". Cardiology in Review 20 (4): 177–183. PMID 22314141. doi:10.1097/CRD.0b013e318244e57c.
- ↑ 15,0 15,1 Di Marco, Elyse; Gray, Stephen P.; Jandeleit-Dahm, Karin (2013). "Diabetes Alters Activation and Repression of Pro- and Anti-Inflammatory Signaling Pathways in the Vasculature". Frontiers in Endocrinology 4: 68. PMC 3672854. PMID 23761786. doi:10.3389/fendo.2013.00068.
- ↑ Srikanth, Velandai; Maczurek, Annette; Phan, Thanh; Steele, Megan; Westcott, Bernadette; Juskiw, Damian; Münch, Gerald (maio de 2011). "Advanced glycation endproducts and their receptor RAGE in Alzheimer's disease". Neurobiology of Aging 32 (5): 763–777. PMID 19464758. doi:10.1016/j.neurobiolaging.2009.04.016.
- ↑ Simm, A.; Wagner, J.; Gursinsky, T.; Nass, N.; Friedrich, I.; Schinzel, R.; Czeslik, E.; Silber, R.E.; Scheubel, R.J. (xullo de 2007). "Advanced glycation endproducts: A biomarker for age as an outcome predictor after cardiac surgery?". Experimental Gerontology 42 (7): 668–675. PMID 17482402. doi:10.1016/j.exger.2007.03.006.
- ↑ Zimmerman, G A; Meistrell, M; Bloom, O; Cockroft, K M; Bianchi, M; Risucci, D; Broome, J; Farmer, P; Cerami, A; Vlassara, H (25 de abril de 1995). "Neurotoxicity of advanced glycation endproducts during focal stroke and neuroprotective effects of aminoguanidine.". Proceedings of the National Academy of Sciences of the United States of America 92 (9): 3744–3748. Bibcode:1995PNAS...92.3744Z. PMC 42038. PMID 7731977. doi:10.1073/pnas.92.9.3744.
- ↑ Shaikh, Shamim; Nicholson, Louise F.B. (xullo de 2008). "Advanced glycation end products induce in vitro cross‐linking of α‐synuclein and accelerate the process of intracellular inclusion body formation". Journal of Neuroscience Research 86 (9): 2071–2082. PMID 18335520. doi:10.1002/jnr.21644.
- ↑ Fuentealba, Denis; Friguet, Bertrand; Silva, Eduardo (xaneiro de 2009). "Advanced Glycation Endproducts Induce Photocrosslinking and Oxidation of Bovine Lens Proteins Through Type-I Mechanism". Photochemistry and Photobiology 85 (1): 185–194. PMID 18673320. doi:10.1111/j.1751-1097.2008.00415.x.
- ↑ Gul, Anjuman; Rahman, M. Ataur; Hasnain, Syed Nazrul (6 de febreiro de 2009). "Role of fructose concentration on cataractogenesis in senile diabetic and non-diabetic patients". Graefe's Archive for Clinical and Experimental Ophthalmology 247 (6): 809–814. PMID 19198870. doi:10.1007/s00417-008-1027-9.
- ↑ Haus, Jacob M.; Carrithers, John A.; Trappe, Scott W.; Trappe, Todd A. (decembro de 2007). "Collagen, cross-linking, and advanced glycation end products in aging human skeletal muscle". Journal of Applied Physiology 103 (6): 2068–2076. PMID 17901242. doi:10.1152/japplphysiol.00670.2007.
- ↑ 23,0 23,1 23,2 23,3 23,4 23,5 23,6 Gugliucci A, Bendayan M (1996). "Renal fate of circulating advanced glycated end products (AGE): evidence for reabsorption and catabolism of AGE peptides by renal proximal tubular cells". Diabetologia 39 (2): 149–60. PMID 8635666. doi:10.1007/BF00403957.
- ↑ 24,0 24,1 24,2 Yan, Hai-dong; Li, Xue-zhu; Xie, Jun-mei; Li, Man (maio de 2007). "Effects of advanced glycation end products on renal fibrosis and oxidative stress in cultured NRK-49F cells". Chinese Medical Journal 120 (9): 787–793. PMID 17531120. doi:10.1097/00029330-200705010-00010.
- ↑ Kostolanská J, Jakus V, Barák L (maio de 2009). "HbA1c and serum levels of advanced glycation and oxidation protein products in poorly and well controlled children and adolescents with type 1 diabetes mellitus". Journal of Pediatric Endocrinology & Metabolism 22 (5): 433–42. PMID 19618662. doi:10.1515/JPEM.2009.22.5.433.
- ↑ Ninomiya, T.; et al. (2001). "A novel AGE production inhibitor, prevents progression of diabetic nephropathy in STZ-induced rats". Diabetes. 50 Suppl. (2): A178–179.
- ↑ 27,0 27,1 Bierhaus A, Hofmann MA, Ziegler R, Nawroth PP (marzo de 1998). "AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus. I. The AGE concept". Cardiovascular Research 37 (3): 586–600. PMID 9659442. doi:10.1016/S0008-6363(97)00233-2.
- ↑ Thornalley, P.J. (1996). "Advanced glycation and the development of diabetic complications. Unifying the involvement of glucose, methylglyoxal and oxidative stress". Endocrinol. Metab 3: 149–166.
- ↑ Hofmann MA, Drury S, Fu C, Qu W, Taguchi A, Lu Y, Avila C, Kambham N, Bierhaus A, Nawroth P, Neurath MF, Slattery T, Beach D, McClary J, Nagashima M, Morser J, Stern D, Schmidt AM (xuño de 1999). "RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides". Cell 97 (7): 889–901. PMID 10399917. doi:10.1016/S0092-8674(00)80801-6.
- ↑ 30,0 30,1 Ansari NA, Moinuddin, Ali R (2011). "Glycated lysine residues: a marker for non-enzymatic protein glycation in age-related diseases". Disease Markers 30 (6): 317–324. PMC 3825483. PMID 21725160. doi:10.1155/2011/718694.
- ↑ 31,0 31,1 Wells-Knecht KJ, Zyzak DV, Litchfield JE, Thorpe SR, Baynes JW (1995). "Mechanism of autoxidative glycosylation: identification of glyoxal and arabinose as intermediates in the autoxidative modification of proteins by glucose". Biochemistry 34 (11): 3702–9. PMID 7893666. doi:10.1021/bi00011a027.
- ↑ Huttunen, Henri J.; Fages, Carole; Rauvala, Heikki (xullo de 1999). "Receptor for Advanced Glycation End Products (RAGE)-mediated Neurite Outgrowth and Activation of NF-κB Require the Cytoplasmic Domain of the Receptor but Different Downstream Signaling Pathways". Journal of Biological Chemistry 274 (28): 19919–19924. doi:10.1074/jbc.274.28.19919.
- ↑ Liu, Ting; Zhang, Lingyun; Joo, Donghyun; Sun, Shao-Cong (decembro de 2017). "NF-κB signaling in inflammation". Signal Transduction and Targeted Therapy 2 (1): 17023. PMC 5661633. doi:10.1038/sigtrans.2017.23.
- ↑ Ashraf, Jalaluddin Mohd.; Ahmad, Saheem; Choi, Inho; Ahmad, Nashrah; Farhan, Mohd.; Tatyana, Godovikova; Shahab, Uzma (novembro de 2015). "Recent advances in detection of AGEs: Immunochemical, bioanalytical and biochemical approaches: Technological Progress in Age Detection". IUBMB Life (en inglés) 67 (12): 897–913. doi:10.1002/iub.1450.
- ↑ 35,0 35,1 35,2 Gugliucci A, Mehlhaff K, Kinugasa E, et al. (2007). "Paraoxonase-1 concentrations in end-stage renal disease patients increase after hemodialysis: correlation with low molecular AGE adduct clearance". Clin. Chim. Acta 377 (1–2): 213–20. PMID 17118352. doi:10.1016/j.cca.2006.09.028.
- ↑ Smedsrød B, Melkko J, Araki N, Sano H, Horiuchi S (1997). "Advanced glycation end products are eliminated by scavenger-receptor-mediated endocytosis in hepatic sinusoidal Kupffer and endothelial cells". Biochem. J. 322 (Pt 2): 567–73. PMC 1218227. PMID 9065778. doi:10.1042/bj3220567.
- ↑ Svistounov D, Smedsrød B (2004). "Hepatic clearance of advanced glycation end products (AGEs)—myth or truth?". J. Hepatol. 41 (6): 1038–40. PMID 15582139. doi:10.1016/j.jhep.2004.10.004.
- ↑ Koschinsky, Theodore; He, Ci-Jiang; Mitsuhashi, Tomoko; Bucala, Richard; Liu, Cecilia; Buenting, Christina; Heitmann, Kirsten; Vlassara, Helen (10 de xuño de 1997). "Orally absorbed reactive glycation products (glycotoxins): An environmental risk factor in diabetic nephropathy". Proceedings of the National Academy of Sciences of the United States of America 94 (12): 6474–6479. Bibcode:1997PNAS...94.6474K. PMC 21074. PMID 9177242. doi:10.1073/pnas.94.12.6474.
- ↑ 39,0 39,1 Chaudhuri, Jyotiska; Bose, Neelanjan; Gong, Jianke; Hall, David; Rifkind, Alexander; Bhaumik, Dipa; Peiris, T. Harshani; Chamoli, Manish; Le, Catherine H.; Liu, Jianfeng; Lithgow, Gordon J.; Ramanathan, Arvind; Shawn Xu, X. Z.; Kapahi, Pankaj (21 de novembro de 2016). "A Caenorhabditis elegans Model Elucidates a Conserved Role for TRPA1-Nrf Signaling in Reactive Alpha-dicarbonyl Detoxification". Current Biology 26 (22): 3014–3025. PMC 5135008. PMID 27773573. doi:10.1016/j.cub.2016.09.024.
- ↑ Mohmmad Abdul, Hafiz; Butterfield, D. Allan (febreiro de 2007). "Involvement of PI3K/PKG/ERK1/2 signaling pathways in cortical neurons to trigger protection by cotreatment of acetyl-L-carnitine and α-lipoic acid against HNE-mediated oxidative stress and neurotoxicity: Implications for Alzheimer's disease". Free Radical Biology and Medicine 42 (3): 371–384. PMC 1808543. PMID 17210450. doi:10.1016/j.freeradbiomed.2006.11.006.
- ↑ Nandhini AT, Thirunavukkarasu V, Anuradha CV (August 2005). "Taurine prevents collagen abnormalities in high fructose-fed rats" (PDF). Indian J. Med. Res. 122 (2): 171–7. PMID 16177476. Arquivado dende o orixinal (PDF) o 2009-04-17. Consultado o 2009-04-16.
- ↑ A. Gugliucci, "Sour Side of Sugar, A Glycation Web Page Arquivado 1 de xullo de 2007 en Wayback Machine.
- ↑ Urios, P.; Grigorova-Borsos, A.-M.; Sternberg, M. (2007). "Aspirin inhibits the formation of... preview & related info". Diabetes Research and Clinical Practice 77 (2): 337–340. PMID 17383766. doi:10.1016/j.diabres.2006.12.024. Consultado o 2013-11-13.
- ↑ Bucala, Richard; Cerami, Anthony (1992). Advanced Glycosylation: Chemistry, Biology, and Implications for Diabetes and Aging. Advances in Pharmacology 23. pp. 1–34. ISBN 978-0-12-032923-6. PMID 1540533. doi:10.1016/S1054-3589(08)60961-8.
- ↑ Guiotto, Andrea; Calderan, Andrea; Ruzza, Paolo; Borin, Gianfranco (1 de setembro de 2005). "Carnosine and Carnosine-Related Antioxidants: A Review". Current Medicinal Chemistry 12 (20): 2293–2315. PMID 16181134. doi:10.2174/0929867054864796.
- ↑ 46,0 46,1 46,2 Rahbar, S; Figarola, JL (2013-03-25). "Novel inhibitors of advanced glycation endproducts". Arch. Biochem. Biophys. 419 (1): 63–79. PMID 14568010. doi:10.1016/j.abb.2003.08.009.
- ↑ Mizutani, Kenichi; Ikeda, Katsumi; Yamori, Yukio (xullo de 2000). "Resveratrol Inhibits AGEs-Induced Proliferation and Collagen Synthesis Activity in Vascular Smooth Muscle Cells from Stroke-Prone Spontaneously Hypertensive Rats". Biochemical and Biophysical Research Communications 274 (1): 61–67. PMID 10903896. doi:10.1006/bbrc.2000.3097.
- ↑ Tang, Youcai; Chen, Anping (10 de marzo de 2014). "Curcumin eliminates the effect of advanced glycation end-products (AGEs) on the divergent regulation of gene expression of receptors of AGEs by interrupting leptin signaling". Laboratory Investigation 94 (5): 503–516. PMC 4006284. PMID 24614199. doi:10.1038/labinvest.2014.42.
- ↑ Bakris, George L.; Bank, Alan J.; Kass, David A.; Neutel, Joel M.; Preston, Richard A.; Oparil, Suzanne (1 de decembro de 2004). "Advanced glycation end-product cross-link breakersA novel approach to cardiovascular pathologies related to the aging process". American Journal of Hypertension 17 (S3): 23S–30S. PMID 15607432. doi:10.1016/j.amjhyper.2004.08.022.
- ↑ Vasan, Sara; Zhang, Xin; Zhang, Xini; Kapurniotu, Aphrodite; Bernhagen, Jürgen; Teichberg, Saul; Basgen, John; Wagle, Dilip; Shih, David; Terlecky, Ihor; Bucala, Richard; Cerami, Anthony; Egan, John; Ulrich, Peter (xullo de 1996). "An agent cleaving glucose-derived protein crosslinks in vitro and in vivo". Nature 382 (6588): 275–278. Bibcode:1996Natur.382..275V. PMID 8717046. doi:10.1038/382275a0.
- ↑ Jean, Daniel; Pouligon, Maryse; Dalle, Claude (2015). "Evaluation in vitro of AGE-crosslinks breaking ability of rosmarinic acid". Glycative Stress Research 2 (4): 204–207. doi:10.24659/gsr.2.4_204.
- ↑ Monnier, Vincent M.; Mustata, Georgian T.; Biemel, Klaus L.; Reihl, Oliver; Lederer, Marcus O.; Zhenyu, Dai; Sell, David R. (xuño de 2005). "Cross-Linking of the Extracellular Matrix by the Maillard Reaction in Aging and Diabetes: An Update on 'a Puzzle Nearing Resolution'". Annals of the New York Academy of Sciences 1043 (1): 533–544. Bibcode:2005NYASA1043..533M. PMID 16037276. doi:10.1196/annals.1333.061.
- ↑ Furber, John D. (xuño de 2006). "Extracellular Glycation Crosslinks: Prospects for Removal". Rejuvenation Research 9 (2): 274–278. PMID 16706655. doi:10.1089/rej.2006.9.274.