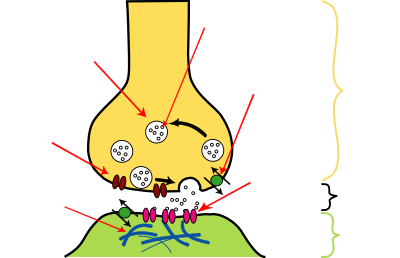
Sinapse química

As sinapses químicas son unións biolóxicas establecidas polas neuronas a través das cales os sinais químicos (neurotransmisores) enviados pola neurona poden pasar a outra neurona ou a unha célula non neuronal, como as células do músculo ou de glándulas. As sinapses químicas permiten que as neuronas formen redes e circuítos no sistema nervioso central e o sistema nervioso funcione, permitindo a percepción, o pensamento e o control de todos os sistemas do corpo.
Nunha sinapse química unha neurona libera moléculas neurotransmisoras nun pequeno espazo (a fenda sináptica) que a separa doura neuronan. Os neurotransmisores encóntranse dentro de vesículas sinápticas, e son liberados na fenda sináptica por exocitose. Estas moléculas atravesas a fenda sináptica e únense despois aos receptores de neurotransmisores na membrana da célula postsináptica. Finalmente, os neurotransmisores deben ser retirados da sinapse por varios mecanismos como a degradación encimática ou a recaptación por transportadores específicos da célula presináptica ou da neuroglía.
O cerebro humano adulto estímase que contén de 1014 a 5 × 1014 sinapses.[1] Cada milímetro cúbico do córtex cerebral contén aproximadamente mil millóns (109) delas.[2][3]
A palabra "sinapse" vén de "synaptein", que Charles Scott Sherrington acuñaron do grego "syn-" ("xuntos") e "haptein" ("agarrar"). Ademais das sinapses químicas, que son as máis comúns e as sinapses por antonomasia cando non se especifica outra cousa, existen tamén as sinapses eléctricas e o termo tamén se usa en bioloxía para outras unións que non teñen que ver coa transmisión nerviosa como as sinapses inmunolóxicas e sinapses cromosómicas.
Estrutura
[editar | editar a fonte]| Estrutura dunha sinapse química típica. |
|---|
As sinapses son conexións funcionais entre as neuronas ou entre neuronas e outros tipos de células.[4][5] Unha neurona típica dá lugar a varios miles de sinapses, aínda que algúns tipos de neuronas fan menos.[6] A maioría das sinapses conectan os axóns coas dendritas (sinapses axo-dendríticas),[7][8] pero hai tamén outros tipos de conexións, incluíndo as de axón-corpo celular (sinapses axo-somáticas),[9][10] axón-axón (sinapses axo-axónicas),[9][10] e dendrita-dendrita (sinapses dendrodendríticas).[8] As sinapses son xeralmente demasiado pequenas para ser recoñecibles usando microscopio óptico excepto como puntos onde as membranas de dúas células parecen tocarse, pero os seus elementos poden visualizarse claramente usando microscopio electrónico.
As sinapses químicas pasan información direccionalmente desde unha célula presináptica a unha célula postsináptica e son, por tanto, asimétricas en estrutura e función. O terminal axónico presináptico, ou botón sináptico, é unha área especializada do axón da célula presináptica que contén vesículas sinápticas cargadas de neurotransmisores, xunto con outras estruturas de soporte e orgánulos como mitocondrias. As vesículas sinápticas están unidas a zonas da membrana plasmática presináptica en rexións chamadas zonas activas.
Oposta a esta está unha rexión da célula postsináptica que contén receptores para os neurotransmisores; para as sinapses entre dúas neuronas a rexión postsináptica pode encontrarse nas dendritas do corpo celular. Inmediatamente detrás da membrana postsináptica está un elaborado complexo de proteínas entrelazadas chamadas a densidade postsináptica.
As proteínas da densidade postsináptica están implicadas na ancoraxe e tráfico de receptores de neurotransmisores e modulan a actividade destes receptores. Os receptores e a densidade postsináptica encóntranse a miúdo en protrusións especializadas que parten do tronco dendrítico principal chamadas espiñas dendríticas.
As sinapses poden describirse como simétricas ou asimétricas. Cando se examinan con microscopio electrónico, as sinapses asimétricas están caracterizadas por ter vesículas arrredondadas na célula presináptica, e unha prominente densidade postsináptica. As sinapses asimétricas son tipicamente excitatorias. As sinaposes simétricas, ao contrario, teñen vesículas aplanadas ou alongadas, e non conteñen unha densidade postsináptica prominente. As sinapses simétricas son tipicamente inhibidoras.
A fenda sináptica, tamén chamada espazo sináptico, é o espazo que hai entre as células pre- e postsinápticas que ten unha largura duns 20 nm. O pequeno volume da fenda permite que a concentración de neurotransmisor se eleve e diminúa rapidamente.[11]
Unha autapse é unha sinapse química ou eléctrica formada cando o axón dunha neurona fai sinapse con dendritas da propia neurona.
Sinalización en sinapses químicas
[editar | editar a fonte]Resumo
[editar | editar a fonte]Velaquí un resumo da secuencia de eventos que teñen lugar na transmisión sináptica desde unha neurona presináptica a unha célula postsináptica. Cada paso é explicado en máis detalle máis adiante. Nótese que coa excepción do paso final, o proceso complexo pode realizarse en só uns centos de microsegundos, nas sinapses máis rápidas.[12]
- O proceso empeza cunha onda de excitación electroquímica chamada potencial de acción que viaxa ao longo da membrana da célula presináptica ata que chega á sinapse.
- A despolarización eléctrica da membrana na sinapse causa que as canles se abran e sexan permeables ao ión calcio.
- Os ións calcio flúen a través da membrana presináptica, incrementando rapidamente a concentración de calcio no interior.
- A concentración alta de calcio activa un conxunto de proteínas sensibles ao calcio unidas a vesículas que conteñen un neurotransmisor químico.
- Estas proteínas cambian de forma, causando que as membranas dalgunhas vesículas "atracadas" se fusionen coa membrana da célula presináptica, abríndose así ao exterior e vertendo o seu cargamento de neurotransmisores na fenda sináptica, o estreito espazo entre as membranas das células pre- e postsináptica.
- O neurotransmisor difunde na fenda sináptica. Algúns escapan, pero outros únense ás moléculas do receptor químico localizadas sobre a membrana da célula postsináptica.
- A unión do neurotransmisor causa que a molécula receptora se active. Hai varios tipos de activación, como se describe con máis detalle máis adiante. Este é o paso clave por medio do cal o proceso sináptico afecta ao comportamento da célula postsináptica.
- Debido á vibración termal, o movemento dos átomos, vibrando desde as súas posicións de equilibrio nun sólido cristalino, as moléculas de neurotransmisor finalmente libéranse dos receptores e difunden.
- O neurotransmisor pode ser reabsorbido pola célula presináptica e despois reempaquetado para unha nova liberación, ou ben é degradado metabolicamente.
Liberación do neurotransmisor
[editar | editar a fonte]
A liberación do neurotransmisor é desencadeada pola chegada dun impulso nervioso (ou potencial de acción) e ocorre por un proceso especialmene rápido de secreción celular (exocitose). Na terminal nerviosa presináptica, as vesículas que conteñen o neurotransmisor están localizadas preto da membrana sináptica. O potencial de acción que chega produce un influxo de ións calcio a través de canle iónica selectiva para o calcio dependente de voltaxe ao final do potencial de acción.[13] Os ións calcio únese despois a proteínas sinaptotagminas que se encontran na membrana das vesículas sinápticas, o que permite que as vesículas se fusionen coa membrana presináptica[14]. A fusión dunha vesícula é un proceso estocástico, que causa frecuentemente o fallo da transmisión sináptica nas sinapses moi pequenas típicas do sistema nervioso central. Por outra parte, as sinapses químicas grandes (por exemplo nas dunha unión neuromuscuar) teñen unha probabilidade de liberación sináptica de 1. A fusión de vesículas é implsada pola acción dun grupo de proteínas do terminal sináptico chamadas SNARE. En conxunto, o complexo proteico ou estrutura que media o atraque e a fusión de vesículas presinápticas denomínase zona activa.[15] A membrana engadida no proceso de fusión é despois recuperada por endocitose e reciclada para a formación de novas vesículas cheas de neurotransmisor.
Unha excepción á tendencia xeral da liberación do neurotransmisor por fusión vesicular encóntrase nas células receptoras de tipo II de papilas gustativas de mamífero. Aquí libérase o neurotransmisor ATP directamente desde o citoplasma á fenda sináptica por medio de canles reguladas por voltaxe.[16]
Unión ao receptor
[editar | editar a fonte]Os receptores do lado oposto do espazo sináptico únense ás moléculas de neurotransmisor. Os receptores poden responder de dúas maneiras posibles. Primeiro, os receptores poden abrirse directamente a canles iónicas ligadas por ligando da membrana postsináptica, causando que os ións entren ou saian da célula e cambien o potencial transmembrana local.[12] O cambio de voltaxe resultante denomínase potencial postsináptico. En xeral, o resultado é excitatorio no caso de correntes de despolarización, e inhibitorio no caso de correntes hiperpolarizantes. Que unha sinapse sexa excitatoria ou inhibitoria depende do tipo de canle iónica conduce as corentes postsinápticas, que á súa vez é unha función do tipo de receptores e neurotransmisor empregados na sinapse. O segundo modo en que o receptor pode afectar o potencial de membrana é modulando a produción de mensaxeiros químicos dentro da neurona postsináptica. Estes segundos mensaxeiros poden despois amplificar a resposta excitatoria ou inhibitoria ante os neurotransmisores.[12]
Terminación
[editar | editar a fonte]Unha vez que un neurotransmisor se une a un receptor, debe despois ser retirado para permitir que a membrana postsináptica continúe transmitindo máis potenciais excitatorios postsinápticoss ou potenciais postsinápticos inhibitorios. Esta retirada pode acontecer por medio de varios procesos:
- O neurotransmisor pode difundir debido a oscilacións inducidas termicamente de neurotransmisor e receptor, deixándoo en disposición de ser degradado metabolicamente fóra da neurona ou de ser reabsorbido.[17]
- Encimas situados na membrana subsináptica poden inactivar/metabolizar o neurotransmisor.
- Bombas de recaptación poden bombear activamente o transmisor de volta ao terminal axónico presináptico para reprocesalo e reliberalo unha vez que chegue o seguinte potencial de acción.[17]
Forza sináptica
[editar | editar a fonte]A forza dunha sinapse foi definida por Bernard Katz como o produto da probabilidade de liberación (presináptica) pr, polo tamaño cuántico q (a resposta postsináptica á liberación dunha soa vesícula de neurotransmisor, un 'cuanto'), e por n, o número de sitios de liberación. O termo "conexión unitaria" refírese xeralmente a un número descoñecido de sinapses individuais que conectan unha neurona presináptica a outra postsináptica. A amplitude dos potenciais postsinápticos pode ser de só 0,4 mV ou de ata 20 mV.[18] A amplitude dos potenciais postsinápticos pode ser modulado por neuromoduladores ou poden cambiar como resultado da actividade previa. Os cambios na forza sináptica poden ser a curto prazo, que duran segundos ou minutos, ou a longo prazo (potenciación a longo prazo), que duran horas. A aprendizaxe e a memoria crese que son o resultado de cambios a longo prazo na forza sináptica, por un mecanismo coñecido como plasticidade sináptica.
Desensibilización do receptor
[editar | editar a fonte]A desensibilización dos receptores postsinápticos é unha diminución da resposta ao mesmo estímulo neurotransmisor. Isto significa que a forza dunha sinapse pode en efecto diminuír a medida que chega un tren de potenciais de acción en rápida sucesión, un fenómeno que dá lugar á chamada dependencia da frecuencia das sinapses. O sistema nervioso explota esta propiedade para propósitos computacionais e pode afinar as súas sinapses por medio da fosforilación das proteínas implicadas.
Plasticidade sináptica
[editar | editar a fonte]A transmisión sináptica pode ser cambiada pola actividade previa. Estes cambios denomínanse plasticidade sináptica e poden ter como resultado unha diminución na eficacia da sinapse, chamada depresión, ou un incremento de eficacia, chamada potenciación. Estes cambios poden ser a longo prazo ou a curto prazo. As formas da plasticidade sináptica a curto prazo poden ser a fatiga sináptica ou depresión e o aumento sináptico. As formas da plasticidade sináptica a longo prazo poden ser a depresión a longo prazo e a potenciación a longo prazo. A plasticidade sináptica pode ser homosináptica (que ocorre nunha sinapse individual) ou heterosináptica (que ocorre en múltiples sinapses).
Plasticidade homosináptica
[editar | editar a fonte]A plasticidade homosináptica (ou tamén modulación homotrópica) é un cambio na forza sináptica resultado da historia da actividade nunha determinada sinapse. Isto pode orixinarse por cambios no calcio presináptico e na retroalimentación sobre os receptores presinápticos, é dicir, unha forma de sinalización autócrina. A plasticidade homosináptica pode afectar ao número e velocidade de recarga das vesículas ou pode afectar as relacións entre a liberación de vesículas e de calcio. A plasticidade homosináptica pode ter tamén unha natureza postsináptica. Pode causar un incremento ou un decrecemento da forza sináptica.
Un exemplo atopámolo nas neuronas do sistema nervioso simpático (SNS), que liberan noradrenalina, que, ademais de afectar a receptores postsinápticos, tamén afecta a receptores adrenérxicos α2 presinápticos, inhibindo a liberación de noradrenalina.[19] Este efecto é utilizado con clonidina para realizar efectos inhibitorios sobre o sistema nerviosos simpático.
Plasticidade heterosináptica
[editar | editar a fonte]A plasticidade heterosináptica (ou tamén a modulación heterotrópica) é un cambio da forza sináptica causado da actividade doutras neuronas. De novo, a plasticidade pode alterar a cantidade de vesículas ou a súa velocidade de recarga ou a relación entre a liberación de vesícula e de calcio. Adicionalmente, podería afectar directamente ao influxo de calcio. A plasticidade heterosináptica pode tamén ser de natureza postsináptica, afectando á sensibilidade do receptor.
Un exemplo é de novo o das neuronas do sistema nervioso simpático, as cales liberan noradrenalina, que xera un efecto inhibitorio sobre as terminais presinápticas de neuronas do sistema nervioso parasimpático.[19]
Integración de entradas sinápticas
[editar | editar a fonte]- Artigo principal: Sumación (neurofisioloxía).
En xeral, se unha sinapse excitatoria é suficientemente forte, un potencial de acción na neurona presináptica desencadea un potencial de acción na célula postsináptica. En moitos casos o potencial postsináptico excitatorio non chega ao limiar necesario para orixinar un potencial de acción. Cando os potenciais de acción de múltiples neuronas presinápticas se disparan simultaneamente, ou se unha soa neurona presináptica dispara a unha frecuencia o suficientemente alta, o potencial postsináptico excitatorio pode solaparse e sumarse. Se se solapan suficientes potenciais postsinápticos excitatorios, o potencial sumado pode chegar ao limiar para poder iniciar un potencial acción. Este proceso é coñecido como sumación, e pode servir como un filtro de alto paso para neuronas.[20]
Por outra parte, unha neurona presináptica que libera un neurotransmisor inhibitorio, como o GABA, pode causar un potencial postsináptico inhibitorio na neurona postsináptica, levando o potencial de membrana alén do limiar, diminuíndo a súa excitabilidade e facendo máis difícil que a neurona inicie un potencial de acción. Se un potencial postsináptico inhibitorio solápase cun potencial postsináptico excitatorio, este último en moitos casos impide que a neurona dispare un potencial de acción. Nesta vía, a saída (output) dunha neurona pode depender da entrada (input) de moitas neuronas diferentes, cada unha das cales ten un grao diferente de influencia, dependendo da forza e o tipo de sinapse con esa neurona. John Carew Eccles realizou algúns dos importantes experimentos iniciais sobre integración sináptica, polos cales recibiu o premio Nobel de Medicina de 1963. As complexas relacións de entrada/saída constitúen a base de computacións baseadas en transistores en computadoras, e pénsase que son similares aos circuítos neurais.
Transmisión de volume
[editar | editar a fonte]Cando se libera un neurotransmisor nunha sinapse, alcanza a súa concentración máis alta dentro do estreito espazo da fenda sináptica, pero algúns deles difunden antes de ser reabsorbidos ou degradados. Se difunde, ten o potencial para activar receptores que están localizados noutras sinapses ou na membrana lonxe dunha sinapse. A actividade extrasináptica dun neurotransmisor denomínase transmisión de volume.[21] Esta ben establecido que tales efectos ocorren nalgún grao, pero a súa importancia funcional foi durante moito tempo un asunto discutido.[22]
Traballos recentes indican que a transmisión de volume pode ser o modo predominante de interacción para algúns tipos especiais de neuronas. No córtex cerebral de mamíferos unha clase de neuronas denominadas células neurogliaformes poden inhibir outras neuronas corticais próximas ao liberaren o neurotransmisor GABA no espazo extracelular.[23] Ao longo dunha mesma vea, o GABA liberado de células neurogliaformes no espazo extracelular tamén actúa sobre os astrocitos dos aredores, asignando un papel á transmisión de volume no control da homeostase iónica e de neurotransmisores.[24] Aproximadamente o 78% dos botóns de células neurogliaformes non forman sinapses clásicas. Este pode ser o primeiro exemplo definitivo de neuronas que se comunican quimicamente nas que as sinapses clásicas non están presentes."[23]
Relacións coas sinapses eléctricas
[editar | editar a fonte]Unha sinapse eléctrica é unha ligazón electricamente condutora entre dúas neuronas contiguas que se forma nun estreito espazo entre as células pre- e postsinápticas, coñecido como unión comunicante. Nas unións comunicantes, as células aproxímanse a uns 3,5 nm, en vez de aos 20 a 40 nm de distancia que separa as células nas sinapses químicas.[25][26] A difernza das sinapses químicas, o potencial postsináptico en sinapses eléctricas non está causado pola apertura de canles iónicas por transmisores químicos, senón polo acoplamento eléctrico directo das dúas neuronas. As sinapses eléctricas son máis rápidas que as sinapses químicas.[11] As sinapses eléctricas encóntranse por todo o sistema nervioso, incluíndo a retina, o núcleo reticular do tálamo, o neocórtex e o hipocampo.[27] Mentres que as sinapses químicas encóntranse en neuronas excitaorias e inhibitorias, as sinapses eléctricas encóntranse principalmente entre neuronas inhibitorias máis pequenas. As sinapses eléctricas poden formarse entre dous axóns, dúas dendritas ou entre un axón e unha dendrita.[28][29] Nalgúns peixes e anfibios, as sinapses eléctricas poden encontrarse ambas no mesmo terminal dunha sinapse química, como acontece nas células de Mauthner.[30]
Efectos das drogas
[editar | editar a fonte]Unha das características máis importantes das sinapses químicas é que son o sitio de acción para a maioría das dcrogas psicoactivas. Moitas drogas afectan as sinapses, como o curare, estricnina, cocaína, morfina, alcohol, LSD e moitas outras. Estas drogas teñen diferentes efectos sobre a función sináptica, e adoitan estar restrinxidas a sinapses químicas que usan un neurotransmisor específico. Por exemplo, o curare é un veleno que impide que a acetilcolina despolarice a membrana postsináptica, causando parálise. A estricnina bloquea os efectos inhibitorios do neurotransmisor glicina, o que causa que o corpo capte e reaccione a estímulos máis febles e previamente ignorados, causando incontrolables espasmos musculares. A morfina actúa sobre as sinapses químicas que utilizan como neurotransisores endorfinas. O alcohol incrementa os efectos inhibitorios do neurotransmisor GABA. O LSD interfire con sinapses que usan o neurotransmisor serotonina. A cocaína bloquea a recaptación de dopamina e, por tanto, incrementa os seus efectos.
Historia
[editar | editar a fonte]Durante a década de 1950, Bernard Katz e Paul Fatt observaron correntes sinápticas en miniatura espontáneas nas unións neuromusculares de ras. Baseándose nestas observacións, desenvolveron a 'hipótese cuántica' que é a base do actual coñecemento da liberación do neurotransmisor por exocitose e polo cal Katz recibiu o Premio Nobel de Medicina de 1970. A finais da década de 1960, Ricardo Miledi e Katz avanzaron a hipótese de que o influxo dos ions de calcio inducido pola despolarización desencadea a exocitose.
Notas
[editar | editar a fonte]- ↑ Drachman D (2005). "Do we have brain to spare?". Neurology 64 (12): 2004–5. PMID 15985565. doi:10.1212/01.WNL.0000166914.38327.BB.
- ↑ Alonso-Nanclares L, Gonzalez-Soriano J, Rodriguez JR, DeFelipe J (September 2008). "Gender differences in human cortical synaptic density". Proc. Natl. Acad. Sci. U.S.A. 105 (38): 14615–9. Bibcode:2008PNAS..10514615A. PMC 2567215. PMID 18779570. doi:10.1073/pnas.0803652105.
- ↑ Brain Facts and Figures Washington University.
- ↑ Rapport, Richard L. (2005). Nerve Endings: The Discovery of the Synapse (Digitized online by Googlebooks). W. W. Norton & Company. pp. 1–37. ISBN 978-0-393-06019-5. Consultado o 2008-12-26.
- ↑ Squire, Larry R.; Floyd Bloom; Nicholas Spitzer (2008). Fundamental Neuroscience. Academic Press. pp. 425–6. ISBN 978-0-12-374019-9.
- ↑ Hyman, Steven E.; Eric Jonathan Nestler (1993). The Molecular Foundations of Psychiatry. American Psychiatric Pub. pp. 425–6. ISBN 978-0-88048-353-7.
- ↑ Smilkstein, Rita (2003). We're Born to Learn: Using the Brain's Natural Learning Process to Create Today's Curriculum. Corwin Press. p. 56. ISBN 978-0-7619-4642-7.
- ↑ 8,0 8,1 Lytton, William W. (2002). From Computer to Brain: Foundations of Computational Neuroscience. Springer. p. 28. ISBN 978-0-387-95526-1.
- ↑ 9,0 9,1 Garber, Steven D. (2002). Biology: A Self-Teaching Guide. John Wiley and Sons. p. 175. ISBN 978-0-471-22330-6.
- ↑ 10,0 10,1 Weiss, Mirin; Dr Steven M. Mirin; Dr Roxanne Bartel (1994). Cocaine. American Psychiatric Pub. p. 52. ISBN 978-1-58562-138-5. Consultado o 2008-12-26.
- ↑ 11,0 11,1 Kandel 2000, p. 182
- ↑ 12,0 12,1 12,2 Bear, Conners, Paradiso (2007). Neuroscience: exploring the brain. Philadelphia, PA: Lippincott Williams & Wilkins. pp. 113-118.
- ↑ Llinás R, Steinberg IZ, Walton K (1981). "Relationship between presynaptic calcium current and postsynaptic potential in squid giant synapse" (PDF). Biophysical Journal 33 (3): 323–351. Bibcode:1981BpJ....33..323L. PMC 1327434. PMID 6261850. doi:10.1016/S0006-3495(81)84899-0.
- ↑ Chapman, Edwin R. (2002). "Synaptotagmin: A Ca2+ sensor that triggers exocytosis?". Nature Reviews Molecular Cell Biology (en inglés) 3 (7): 498–508. ISSN 1471-0080. doi:10.1038/nrm855.
- ↑ Craig C. Garner and Kang Shen. Structure and Function of Vertebrate and Invertebrate Active Zones. Structure and Functional Organization of the Synapse. Ed: Johannes Hell and Michael Ehlers. Springer, 2008.
- ↑ Romanov, Roman A.; Lasher, Robert S.; High, Brigit; Savidge, Logan E.; Lawson, Adam; Rogachevskaja, Olga A.; Zhao, Haitian; Rogachevsky, Vadim V.; Bystrova, Marina F.; Churbanov, Gleb D.; Adameyko, Igor; Harkany, Tibor; Yang, Ruibiao; Kidd, Grahame J.; Marambaud, Philippe; Kinnamon, John C.; Kolesnikov, Stanislav S.; Finger, Thomas E. (2018). "Chemical synapses without synaptic vesicles: Purinergic neurotransmission through a CALHM1 channel-mitochondrial signaling complex". Science Signaling 11 (529): eaao1815. ISSN 1945-0877. doi:10.1126/scisignal.aao1815.
- ↑ 17,0 17,1 Sherwood L., stikawy (2007). Human Physiology 6e: From Cells to Systems
- ↑ Díaz-Ríos M, Miller MW (June 2006). "Target-specific regulation of synaptic efficacy in the feeding central pattern generator of Aplysia: potential substrates for behavioral plasticity?". Biol. Bull. 210 (3): 215–29. PMID 16801496. doi:10.2307/4134559.
- ↑ 19,0 19,1 Rang, H.P.; Dale, M.M.; Ritter, J.M. (2003). Pharmacology (5th ed.). Edinburgh: Churchill Livingstone. p. 129. ISBN 0-443-07145-4.
- ↑ Bruce Alberts; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter, eds. (2002). "Ch. 11. Section: Single Neurons Are Complex Computation Devices". Molecular Biology of the Cell (4th ed.). Garland Science. ISBN 0-8153-3218-1.
- ↑ Zoli M, Torri C, Ferrari R, et al. (1998). "The emergence of the volume transmission concept". Brain Res. Brain Res. Rev. 26 (2–3): 136–47. PMID 9651506. doi:10.1016/S0165-0173(97)00048-9.
- ↑ Fuxe K, Dahlström A, Höistad M, et al. (2007). "From the Golgi-Cajal mapping to the transmitter-based characterization of the neuronal networks leading to two modes of brain communication: wiring and volume transmission". Brain Res Rev 55 (1): 17–54. PMID 17433836. doi:10.1016/j.brainresrev.2007.02.009.
- ↑ 23,0 23,1 Oláh S, Füle M, Komlósi G, et al. (2009). "Regulation of cortical microcircuits by unitary GABA-mediated volume transmission". Nature 461 (7268): 1278–81. Bibcode:2009Natur.461.1278O. PMC 2771344. PMID 19865171. doi:10.1038/nature08503.
- ↑ Rózsa M, Baka J, Bordé S, Rózsa B, Katona G, Tamás G, et al. (2015). "Unitary GABAergic volume transmission from individual interneurons to astrocytes in the cerebral cortex". Brain Structure and Function. PMID 26683686. doi:10.1007/s00429-015-1166-9.
- ↑ Kandel 2000, p. 176
- ↑ Hormuzdi 2004
- ↑ Connors BW, Long MA (2004). "Electrical synapses in the mammalian brain". Annu. Rev. Neurosci. 27 (1): 393–418. PMID 15217338. doi:10.1146/annurev.neuro.26.041002.131128. Arquivado dende o orixinal o 16 de setembro de 2019. Consultado o 02 de xaneiro de 2019.
- ↑ Veruki ML, Hartveit E (December 2002). "Electrical synapses mediate signal transmission in the rod pathway of the mammalian retina". J. Neurosci. 22 (24): 10558–66. PMID 12486148.
- ↑ Bennett MV, Pappas GD, Aljure E, Nakajima Y (March 1967). "Physiology and ultrastructure of electrotonic junctions. II. Spinal and medullary electromotor nuclei in mormyrid fish". J. Neurophysiol. 30 (2): 180–208. PMID 4167209. Arquivado dende o orixinal o 15 de maio de 2016. Consultado o 02 de xaneiro de 2019.
- ↑ Pereda AE, Rash JE, Nagy JI, Bennett MV (December 2004). "Dynamics of electrical transmission at club endings on the Mauthner cells". Brain Res. Brain Res. Rev. 47 (1–3): 227–44. PMID 15572174. doi:10.1016/j.brainresrev.2004.06.010.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Carlson, Neil R. (2007). Physiology of Behavior (9th ed.). Boston, MA: Pearson Education. ISBN 0-205-59389-5.
- Kandel, Eric R.; Schwartz, James H.; Jessell, Thomas M. (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Llinás R, Sugimori M, Simon SM (April 1982). "Transmission by presynaptic spike-like depolarization in the squid giant synapse". Proc. Natl. Acad. Sci. U.S.A. 79 (7): 2415–9. Bibcode:1982PNAS...79.2415L. PMC 346205. PMID 6954549. doi:10.1073/pnas.79.7.2415.
- Llinás R, Steinberg IZ, Walton K (1981). "Relationship between presynaptic calcium current and postsynaptic potential in squid giant synapse". Biophysical Journal 33 (3): 323–352. Bibcode:1981BpJ....33..323L. PMC 1327434. PMID 6261850. doi:10.1016/S0006-3495(81)84899-0.
- Bear, Mark F.; Connors, Barry W.; Paradiso, Michael A. (2001). Neuroscience: Exploring the Brain. Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 0-7817-3944-6.
- Hormuzdi, SG; Filippov, MA; Mitropoulou, G; Monyer, H; Bruzzone, R (March 2004). "Electrical synapses: a dynamic signaling system that shapes the activity of neuronal networks". Biochim Biophys Acta 1662 (1–2): 113–137. PMID 15033583. doi:10.1016/j.bbamem.2003.10.023.
- Karp, Gerald (2005). Cell and Molecular Biology: concepts and experiments (4th ed.). Hoboken, NJ: John Wiley & Sons. ISBN 0-471-46580-1.
- Nicholls, J.G.; Martin, A.R.; Wallace, B.G.; Fuchs, P.A. (2001). From Neuron to Brain (4th ed.). Sunderland, MA: Sinauer Associates. ISBN 0-87893-439-1.
Ligazóns externas
[editar | editar a fonte]- Resumo da sinapse para nenos
- Synapses Arquivado 13 de setembro de 2007 en Wayback Machine. Biologymad.com (2004)
- Synapse – Cell Centered Database
- Atlas of Ultrastructure Neurocytology Gran galería de imaxes de microscopio electrónico recompiladas pololaboratorio de Kristen Harris de sinapses e outras estruturas neuronais.