Succinil coencima A sintetase
| Succinato-CoA ligase (formadora de GDP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| succinil-CoA sintetase específica do GTP de porco con GTP. PDB PDBe 2fp4 [1] | |||||||||
| Identificadores | |||||||||
| Número EC | 6.2.1.4 | ||||||||
| Número CAS | 9014-36-2 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
| Succinato-CoA ligase (formadora de ADP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Succinil-COA sintetase de Escherichia coli. PDB PDBe 2scu [2] | |||||||||
| Identificadores | |||||||||
| Número EC | 6.2.1.5 | ||||||||
| Número CAS | 9080-33-5 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A succinil coencima A sintetase (SCS), tamén chamada succinil-CoA sintetase ou succinato tioquinase ou succinato-CoA ligase, é un encima que cataliza a reacción reversible que converte o succinil-CoA en succinato, que forma parte do ciclo do ácido cítrico ou de Krebs.[3] O encima facilita o acoplamento desta reacción coa formación dunha molécula de nucleósido trifosfato (que pode ser GTP ou ATP) a partir dunha molécula de fosfato inorgánico e outra de nucleósido difosfato (GDP ou ADP). Está localizado na matriz das mitocondrias.[4]
Reacción e mecanismo
[editar | editar a fonte]A succinil-CoA sintetase cataliza a seguinte reacción reversible:
- Succinil-CoA + Pi + NDP ⇌ Succinato + CoA + NTP
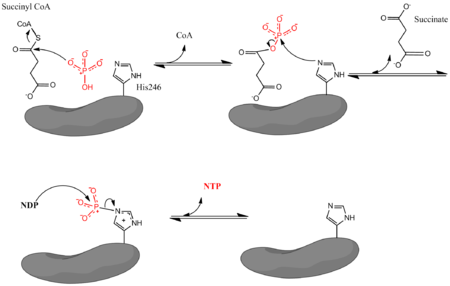
onde Pi significa fosfato inorgánico, NDP é un nucleósido difosfato (GDP ou ADP), e NTP é un nucleósido trifosfato (GTP ou ATP). O encima facilita o acoplamento da conversión do succinil-CoA a succinato con formación de NTP a partir de NDP e Pi, o que se considera unha fosforilación a nivel de substrato. A reacción ten un cambio de enerxía libre no estado bioquímico estándar de -3.4 kJ/mol.[4] A reacción ten lugar por un mecanismo de reacción en tres pasos[3] mostrado na imaxe de máis abaixo. O primeiro paso implica a separación do coencima A (CoA) do succinil-CoA por unha molécula de fosfato inorgánico nucleofílica para formar succinil fosfato. O encima despois utiliza un residuo de histidina para quitar o grupo fosfato do succinil fosfato e xerar succinato. Finalmente, a histidina fosforilada transfire o grupo fosfato a un nucleósido difosfato, o cal xera o nucleósido trifosfato enerxético.
Estrutura
[editar | editar a fonte]Subunidades
[editar | editar a fonte]A succinil-CoA sintetase de bacterias e mamíferos está constituída polas subunidades α e β, que se asocian formando dímeros ou tetrámeros segundo a especie.[5] En Escherichia coli únense dous heterodímeros αβ para formar o heterotetrámero α2β2. Polo contrario, nas mitocondrias de mamíferos o encima activo é un dímero αβ e non forma o heterotetrámero.[6] O heterotetrámeto deste encima en Escherichia coli foi cristalizado e caracterizado con grande detalle.[6][7] Como se ve na imaxe 2, as dúas subunidades α (rosa e verde) sitúanse en lados opostos da estrutura e as dúas subunidades β (amarela e azul) interaccionan na rexión media da proteína. As dúas subunidades α só interaccionan cunha soa subunidade β, mentres que as subunidades β interaccionan cunha das subunidades α (formando o dímero αβ) e coa subunidade β do outro dímero αβ.[6] Unha curta cadea de aminoácidos une as dúas subunidades β, o que dá lugar á estrutura tetramérica.

A estrutura cristalina da subunidade α (isoforma que se une ao succinil-CoA) determinouse a unha resolución de 2,10 Å, e pode verse en PDB código 1CQJ. [1].[8]
Residuos catalíticos
[editar | editar a fonte]As estruturas cristalinas da succinil-CoA sintetase de E. coli proporcionan evidencias de que o coencima A se une a cada unha das subunidades α (nun pregamento Rossman) en estreita proximidade a un residuo de histidina (His246α).[7] Este residuo de histidina é fosforilado durante o paso de formación do succinato no mecanismo de reacción. A localización exacta da zona de unión do succinato non está ben definida.[9] A formación do nucleósido trifosfato ten lugar nun dominio que atrapa o ATP, que está localizado preto do extremo N-terminal de cada subunidade β. Porén, este dominio está localizado a uns 35 Å do residuo de histidina fosforilado.[8] Isto fixo pensar aos investigadores que o encima debe sufrir un cambio conformacional importante para facer que a histidina e dito dominio se acheguen e facilitar a formación do nucleósido trifosfato. Os experimentos de mutaxénese determinaron que dous residuos de glutamato (un preto da histidina catalítica, o residuo Glu208α, e outro preto do dominio que atrapa o ATP, o Glu197β) xogan un importante papel na fosforilación e desfosforilación da histidina, mais o mecanismo exacto polo cal o encima cambia de conformación non se comprende completamente.[9]
Isoformas
[editar | editar a fonte]Johnson et al. describiu dúas isoformas da succinil-CoA sintetase nos mamíferos, unha que é específica para os nucleótidos de adenina, e outra para os de guanosina.[10] A reacción é reversible, polo que poden formar ATP ou GTP (como ocorre normalmente nas células) ou ADP e GDP (na reacción en sentido inverso; por iso as isoformas se chaman "formadoras de ADP" ou "de GDP").
- Número EC: 6.2.1.5 - formadora de ADP - Xene SUCLA2 do cromosoma 13 humano.
- Número EC: 6.2.1.4 - formadora de GDP - Xenes SUCLG1 do cromosoma 2, e SUCLG2 do cromosoma 3.
A forma específica do GTP é a que tradicionalmente[11] se consideraba que interviña normalmente no ciclo do ácido cítrico, pero a expresión da subunidade específica do ATP comprobouse que é forte en moitos tecidos humanos e de rato, o que suxire que a succinil-CoA sintetase específica do ATP ten un papel importante en moitas especies animais,[10] e suxírese que ambas as dúas poderían intervir no ciclo do ácido cítrico, seguramente cunha especialización por tecidos.[11]
Función biolóxica
[editar | editar a fonte]Ciclo do ácido cítrico. O encima é fundamental para que funcione o ciclo do ácido cítrico, xa que ten que transformar o succinil-CoA en succinato, o cal continúa as reaccións do ciclo.
Xeración de nucleósidos trifosfato: A succinil-CoA sintetase é o único encima do ciclo do ácido cítrico que cataliza unha reacción na cal se forma un nucleósido trifosfato (GTP ou ATP) por medio dunha fosforilación a nivel de substrato.[4] Atopouse que en E. coli o encima pode catalizar tanto a formación de GTP coma a de ATP.[7] Porén, os mamíferos posúen distintos tipos de succinil-CoA sintetase (SCS) que son específicos para o GTP (G-SCS) ou o ATP (A-SCS) e son nativos de diferentes tecidos do organismo. Un interesante estudo que utilizou tecidos de pomba mostrou que o encima específico de GTP estaba localizado principalmente no fígado da pomba, e o específico de ATP no músculo da peituga.[12] Outros estudos atoparon fenómenos similares en ratas, ratos e humanos. Parece que os tecidos tipicamente implicados no metabolismo anabólico (como o fígado e os riles) expresan a G-SCS, mentres que os dedicados ao metabolismo catabólico (como o cerebro, corazón, e músculo) expresan a A-SCS.[11]
Formación de intermediatos metabólicos: Este encima facilita o fluxo metabólico de moléculas cara a outras vías metabólicas ao controlar a interconversión entre o succinil-CoA e o succinato.[13] Isto é importante porque o succinil-CoA é un intermediato necesario para a biosíntese de porfirina, hemo,[14] e corpos cetónicos.[15]
Regulación e actividade
[editar | editar a fonte]Regulación e inhibición: En E. coli o encima é regulado a nivel transcricional.[16] Demostrouse que o xene para a succinil-CoA sintetase (sucCD de E. coli) é transcrito xunto co xene da α-cetoglutarato deshidroxenase (sucAB) baixo o control dun promotor chamado sdhC, o cal forma parte do operón da succinato deshidroxenase. Este operón é regulado á alza pola presenza de oxíxeno e responde a diversas fontes de carbono. As drogas antibacterianas que impiden a fosforilación da histidina, como o composto LY26650, son potentes inhibidores da succinil-CoA sintetase bacteriana.[17]
Actividade óptima: As medidas tomadas utilizando succinil-CoA sintetase de soia indican que a súa temperatura óptima de funcionamento é de 37 °C e o seu pH óptimo é 7,0-8,0.[18]
Papel en enfermidades
[editar | editar a fonte]Acidose Láctica Infantil Fatal: Considérase que unha succinil-CoA sintetase defectuosa é a causa da Acidose Láctica Infantil Fatal, que é unha enfermidade que afecta aos meniños, que está caracterizada pola acumulación de niveis tóxicos de ácido láctico. A condición nos casos máis graves pode orixinar a morte xeralmente de 2 a 4 días despois do nacemento.[19] Determinouse que os pacientes con esta condición presentan unha deleción de dous pares de bases no xene SUCLG1 que codifica a subunidade α do encima.[19] Como resultado, nas células non hai unha succinato-CoA sintetase funcional, o que causa un importante desequilibrio no fluxo entre a glicólise e o ciclo do ácido cítrico. Como as células nesas condicións carecen dun ciclo do ácido cítrico funcional, orixínase acidose porque as células se ven forzadas a utilizar a fermentación láctica como fonte primaria para producir ATP.
Notas
[editar | editar a fonte]- ↑ Fraser, M. E.; Hayakawa, K.; Hume, M. S.; Ryan, D. G.; Brownie, E. R. (2006). "Interactions of GTP with the ATP-grasp Domain of GTP-specific Succinyl-CoA Synthetase". Journal of Biological Chemistry 281 (16): 11058–11065. doi:10.1074/jbc.M511785200. PMID 16481318.
- ↑ Fraser, M. E.; James, M. N. G.; Bridger, W. A.; Wolodko, W. T. (1999). "A detailed structural description of Escherichia coli succinyl-CoA synthetase1". Journal of Molecular Biology 285 (4): 1633–1653. doi:10.1006/jmbi.1998.2324. PMID 9917402.
- ↑ 3,0 3,1 Voet, Donald J. (2011). Biochemistry / Donald J. Voet ; Judith G. Voet. New York, NY: Wiley, J. ISBN 978-0-470-57095-1.
- ↑ 4,0 4,1 4,2 Berg, Jeremy M. (Jeremy M.); Tymoczko, John L.; Stryer, Lubert.; Stryer, Lubert. Biochemistry. (2002). Biochemistr. New York: W.H. Freeman. pp. 475–477. ISBN 0-7167-3051-0.
- ↑ Nishimura, JS. (1986). "Succinyl-CoA synthetase structure-function relationships and other considerations.". Adv Enzymol Relat Areas Mol Biol 58: 141–72. PMID 3521216.
- ↑ 6,0 6,1 6,2 Wolodko, WT.; Kay, CM.; Bridger, WA. (1986). "Active enzyme sedimentation, sedimentation velocity, and sedimentation equilibrium studies of succinyl-CoA synthetases of porcine heart and Escherichia coli.". Biochemistry 25 (19): 5420–5. PMID 3535876. doi:10.1021/bi00367a012.
- ↑ 7,0 7,1 7,2 Fraser, ME.; James, MN.; Bridger, WA.; Wolodko, J. (1999). "A detailed structural description of escherichia coli succinly-CoA synthetase". J Mol Biol 288 (3): 501. PMID 10329157. doi:10.1006/jmbi.1999.2773.
- ↑ 8,0 8,1 Joyce, MA.; Fraser, ME.; James, MN.; Bridger, WA.; Wolodko, WT. (2000). "ADP-binding site of Escherichia coli succinyl-CoA synthetase revealed by x-ray crystallography.". Biochemistry 39 (1): 17–25. PMID 10625475. doi:10.1021/bi991696f.
- ↑ 9,0 9,1 Fraser, ME.; Joyce, MA.; Ryan, DG.; Wolodko, WT. (2002). "Two glutamate residues, Glu 208 alpha and Glu 197 beta, are crucial for phosphorylation and dephosphorylation of the active-site histidine residue in succinyl-CoA synthetase.". Biochemistry 41 (2): 537–46. PMID 11781092. doi:10.1021/bi011518y.
- ↑ 10,0 10,1 Johnson JD, Mehus JG, Tews K, Milavetz BI, Lambeth DO (1998). "Genetic evidence for the expression of ATP- and GTP-specific succinyl-CoA synthetases in multicellular eucaryotes". J Biol Chem 273 (42): 27580–6. PMID 9765291. doi:10.1074/jbc.273.42.27580. Arquivado dende o orixinal o 06 de abril de 2008. Consultado o 22 de decembro de 2013.
- ↑ 11,0 11,1 11,2 Lambeth, DO.; Tews, KN.; Adkins, S.; Frohlich, D.; Milavetz, BI. (2004). "Expression of two succinyl-CoA synthetases with different nucleotide specificities in mammalian tissues.". J Biol Chem 279 (35): 36621–4. PMID 15234968. doi:10.1074/jbc.M406884200.
- ↑ Johnson, JD.; Muhonen, WW.; Lambeth, DO. (1998). "Characterization of the ATP- and GTP-specific succinyl-CoA synthetases in pigeon. The enzymes incorporate the same alpha-subunit.". J Biol Chem 273 (42): 27573–9. PMID 9765290. doi:10.1074/jbc.273.42.27573.
- ↑ Labbe, RF.; Kurumada, T.; Onisawa, J. (1965). "The role of succinyl-CoA synthetase in the control of heme biosynthesis.". Biochim Biophys Acta 111 (2): 403–15. PMID 5879477.
- ↑ Ottaway, JH.; McClellan, JA.; Saunderson, CL. (1981). "Succinic thiokinase and metabolic control.". Int J Biochem 13 (4): 401–10. PMID 6263728.
- ↑ Jenkins, TM.; Weitzman, PD. (1986). "Distinct physiological roles of animal succinate thiokinases. Association of guanine nucleotide-linked succinate thiokinase with ketone body utilization.". FEBS Lett 205 (2): 215–8. PMID 2943604. doi:10.1016/0014-5793(86)80900-0.
- ↑ Park, SJ.; Chao, G.; Gunsalus, RP. (1997). "Aerobic regulation of the sucABCD genes of Escherichia coli, which encode alpha-ketoglutarate dehydrogenase and succinyl coenzyme A synthetase: roles of ArcA, Fnr, and the upstream sdhCDAB promoter.". J Bacteriol 179 (13): 4138–42. PMC 179232. PMID 9209026.
- ↑ Hunger-Glaser, I.; Brun, R.; Linder, M.; Seebeck, T. (1999). "Inhibition of succinyl CoA synthetase histidine-phosphorylation in Trypanosoma brucei by an inhibitor of bacterial two-component systems.". Mol Biochem Parasitol 100 (1): 53–9. PMID 10376993.
- ↑ Wider de Xifra, EA.; del C Batlle, AM. (1978). "Porphyrin biosynthesis: immobilized enzymes and ligands. VI. Studies on succinyl CoA synthetase from cultured soya bean cells.". Biochim Biophys Acta 523 (1): 245–9. PMID 564714.
- ↑ 19,0 19,1 Ostergaard, E.; Christensen, E.; Kristensen, E.; Mogensen, B.; Duno, M.; Shoubridge, EA.; Wibrand, F. (2007). "Deficiency of the alpha subunit of succinate-coenzyme A ligase causes fatal infantile lactic acidosis with mitochondrial DNA depletion.". Am J Hum Genet 81 (2): 383–7. PMC 1950792. PMID 17668387. doi:10.1086/519222.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Succinyl Coenzyme A Synthetases Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.