שלפוחית סינפטית
| שיוך |
קדם-סינפסה |
|---|---|
| מזהים | |
| טרמינולוגיה היסטולוגיקה |
H2.00.06.2.00004 |
| קוד MeSH |
A08.850.840 |
| מזהה MeSH |
D013572 |
| מערכת השפה הרפואית המאוחדת |
C0039065 |
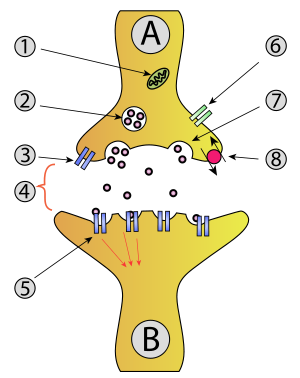
B - תא עצב קולט (בתר-סינפטי)
1. מיטוכונדריון
2. שלפוחית סינפטית המכילה מוליכים עצביים
3. קולטן עצמי
4. מרווח סינפטי דרכו מפעפע מוליך עצבי
5. קולטנים בתר-סינפטיים המופעלים על ידי המוליך העצבי
6. תעלת סידן
7. מוליכים עצביים נפלטים למרווח הסינפטי באקסוציטוזה
8. משאבה לספיגה חוזרת של מוליך עצבי
שלפוחית סינפטית (synaptic vesicle, neurotransmitter vesicle) היא אברון תאי הנמצא בקצה האקסון של תא עצב, ובו נאגרים מוליכים עצביים. מעבר דחף עצבי בסיב העצב מביא למיזוגן של שלפוחיות סינפטיות עם קרום התא ולפליטת המוליך העצבי אל המרווח הסינפטי. מולקולות המוליך העצבי מפעפעות אל קרום התא הבתר-סינפטי ונקשרות לקולטנים; קישור זה מעורר פוטנציאל בתר-סינפטי בתא, שבעקבותיו עשוי להיווצר בו דחף עצבי.
שלפוחיות סינפטיות מיוצרות באופן סדיר על ידי תא העצב, והן הכרחיות לתקשורת תקינה בין תאי עצב. מספר תרופות ורעלנים עצביים משפיעים על מערכת העצבים על ידי התערבות בשלבים שונים בהולכת שלפוחיות סינפטיות.
מחזור החיים של שלפוחיות סינפטיות
[עריכת קוד מקור | עריכה]ייצור ואחסון
[עריכת קוד מקור | עריכה]שלפוחיות סינפטיות מיוצרות בשני אופנים, בהתאם לסוג המוליכים העצביים הנאגרים בהן. שלפוחיות המכילות מולקולות קטנות מיוצרות בטרמינל האקסון עצמו, ואילו שלפוחיות המכילות נוירופפטידים מיוצרות בגוף התא ומוסעות אל הטרמינל. השלפוחיות הבשלות מעוגנות אל סיבי שלד התא, במרחק-מה מקרום התא, בהמתנה לשעת הצורך.
מולקולות קטנות - המוליכים העצביים מיוצרים בציטופלזמה שבטרמינל על ידי אנזימים המיוצרים בגוף התא ונשלחים לאורך האקסון בהובלה איטית (slow axonal transport). מולקולות המוליכים העצביים שבציטופלזמה מועברות לתוך השלפוחיות על ידי חלבוני ממברנה המשולבים בקרום השלפוחיות. לכל מוליך עצבי חלבוני העברה ייחודיים לו, כך שסוג חלבוני ההעברה המצויים על פני השלפוחית קובע את תכולתה.
נוירופפטידים - כמו חלבונים מופרשים אחרים, נוירופפטידים נארזים בשלפוחיות במנגנון גולג'י בגוף התא, ומשם נשלחים לטרמינל בהובלה מהירה (fast axonal transport) על גבי מיקרו-צינוריות שבאקסון.
שלפוחיות סינפטיות מסווגות על פי גודלן ומראן בצילום מיקרוסקופ אלקטרוני:
- שלפוחיות קטנות צלולות ליבה (clear-core) בקוטר 40–60 ננומטר מכילות מולקולות קטנות של מוליכים עצביים (כמו אצטילכולין וחומצות אמינו).
- שלפוחיות דחוסות ליבה (dense-core) קטנות בקוטר 40–60 ננומטר, או גדולות יותר בקוטר 60–120 ננומטר, בעלות צורה לא סדירה, מכילות אמינים ביוגניים.
- שלפוחיות גדולות דחוסות ליבה בקוטר 90–250 ננומטר מכילות נוירופפטידים.
שחרור מוליכים עצביים
[עריכת קוד מקור | עריכה]שחרור המוליכים העצביים למרווח הסינפטי מתרחש כאשר שלפוחיות מתמזגות עם קרום התא באתר ייעודי, המכונה "אזור פעיל", בקרום התא הקדם-סינפטי. כשתא העצב במנוחה רק מקצת השלפוחיות מעוגנות באזורים הפעילים, ומרביתן פזורות הרחק מקרום התא. הגעת דחף עצבי אל קצה הסיב העצבי מביאה להקטנת המתח החשמלי על פני קרום התא ולפתיחת תעלות סידן תלויות מתח, המאפשרות ליוני סידן לחדור אל התא. עליית ריכוז הסידן התוך-תאי מחוללת סדרה של תגובות חלבוניות, המביאות לאיחוי השלפוחית עם קרום התא הקדם סינפטי באזור הפעיל. במסגרת האיחוי נפתחת השלפוחית אל המרווח הסינפטי ותכולתה משתחררת.
שחרור תכולת השלפוחית יכול להתבצע גם באמצעות מנגנון "נשיקה חטופה" (kiss and run): השלפוחית מתאחה באופן רגעי עם קרום התא, והמוליכים העצביים נשפכים ממנה אל המרווח הסינפטי דרך התעלה הצרה הנוצרת. כך התא לא נדרש לבצע את כל שלבי הפליטה והבליעה התאית, ומתאפשר מיחזור מהיר יותר של השלפוחיות. כמות המוליכים עצביים המשתחררת מהשלפוחית בתהליך זה, קטנה יותר מאשר במיזוג מלא של השלפוחית עם קרום התא.
מיחזור שלפוחיות
[עריכת קוד מקור | עריכה]איחוי שלפוחיות עם קרום התא לא רק מגדיל את שטח הקרום, אלא גם מוסיף חלבונים שלפוחיתיים שאינם אמורים להימצא על פני קרום התא (למשל, חלבוני ההעברה של מוליכים עצביים). מנגנון של מיחזור שלפוחיות בבליעה תאית מבטיח שמירה על שטח קרום התא, מחזיר חלבונים ייחודיים לשלפוחיות אל תוך התא ומקצר את משך הזמן הדרוש לחידוש מלאי השלפוחיות בטרמינל.
מנגנונים מולקולריים בדינמיקה של שלפוחיות סינפטיות
[עריכת קוד מקור | עריכה]אגירת מוליך עצבי
[עריכת קוד מקור | עריכה]מעבר מוליך עצבי לתוך שלפוחית נעשה בהובלה פעילה הדורשת השקעת אנרגיה. אנזים ייעודי (hydrogen ATPase) מפרק ATP כמקור אנרגיה ויוצר מפל ריכוזים של פרוטונים (יוני +H). חלבוני ההעברה משתמשים במפל הריכוזים ככוח מניע להעברת מולקולות מוליך עצבי אל תוך השלפוחית. הטבלה הבאה מסכמת את הסטויכיומטריה של הובלת המוליכים העצביים העיקריים:
| סוגי המוליכים העצביים | הובלה לתוך השלפוחית | הוצאה מהשלפוחית |
|---|---|---|
| נוראפינפרין, דופמין, היסטמין, סרוטונין ואצטילכולין | מוליך עצבי מיונן חיובית | 2 פרוטונים |
| GABA וגליצין | מוליך עצבי | פרוטון |
| גלוטמט | מוליך עצבי מיונן שלילית + יון כלור -Cl | פרוטון |
עגינה
[עריכת קוד מקור | עריכה]שלפוחיות במצב מנוחה מעוגנות אל סיבי אקטין ומרכיבים אחרים של שלד התא על ידי חלבונים הנקראים סינפסינים. כניסת יוני סידן אל התא גורמת להפעלת אנזימי קינאז משופעלי-סידן, אשר מזרחנים את הסינפסינים ומרפים את אחיזתם בשלפוחיות.
חלבוני G ייעודיים ממשפחת Rab מנחים את השלפוחיות המשוחררות אל האזורים הפעילים. סבורים כי עגינת השלפוחיות באזורים הפעילים מתבצעת על-פי התאמה בין חלבונים ממשפחת SNARE: חלבוני v-SNARE (vesicle) הצמודים לשלפוחית נקשרים לחלבוני t-SNARE (target) באזור הפעיל. המפגש בין החלבונים מאפשר לשניהם להתקפל ולהצמיד את השלפוחית לקרום התא, בדומה לפעולתה של כננת. מיחזור השלפוחית כרוך בהפרדה בין חלבוני עוגן אלה על ידי החלבונים NSF (N-ethylmaleimide-sensitive fusion protein) ו-SNAP (soluble NSF attachment protein). סביר להניח כי חלבונים נוספים מעורבים בבקרת תהליכים אלה.
איחוי
[עריכת קוד מקור | עריכה]עליית ריכוז הסידן התוך-תאי משפעלת את החלבונים סינפטוטגמין (Synaptotagmin) ומשפחת SNARE, ופעילותם מאחה את השלפוחית עם קרום התא הקדם סינפטי באזור הפעיל.
מחלות
[עריכת קוד מקור | עריכה]מספר תסמונות נדירות של חולשת שרירים (myasthenic syndromes) נובעות מפגיעה בתפקוד הנורמלי של שלפוחיות סינפטיות בעצבים תנועתיים, ובהחלשת האותות שעצבים אלה שולחים לשרירים.
תסמונת למברט-איטון (Lambert-Eaton myasthenic syndrome) היא סיבוך המופיע בחולי סרטן ריאה שמפתחים, מסיבות לא ידועות, נוגדנים לתעלות סידן. הירידה במספר תעלות הסידן הקדם-סינפטיות גורמת לצימצום מספר השלפוחיות המשחררות מוליך עצבי בסינפסה, אף על פי שהשלפוחיות עצמן נורמליות. הטיפול במחלה מתמקד בסילוק הנוגדנים על ידי ניקוי פלזמת הדם או על ידי דיכוי תרופתי של מערכת החיסון.
תסמונות מיאסתניות מולדות מסוימות נובעות מפגמים גנטיים בתהליך הייצור של שלפוחיות אצטילכולין בעצבים מוטוריים, המקטינים את מספר השלפוחיות בתא ואת כמות המוליך העצבי שיכול להשתחרר בסינפסה. משערים שמקור התסמונת בפגם בתהליך מיחזור השלפוחיות או במעברן מגוף התא אל הטרמינל. בתסמונת תורשתית נוספת (familial infantile myasthenia) נראה שמספר השלפוחיות בתא נורמלי, אך הן קטנות מהרגיל כתוצאה מפגם גנטי אחר בתהליך המיחזור.
רעלנים ותרופות
[עריכת קוד מקור | עריכה]מספר רעלנים עצביים מפריעים לפעילותן של שלפוחיות סינפטיות ומשפיעים על האותות המועברים מעצבים תנועתיים אל השרירים. רעלנים המיוצרים על ידי חיידקים מהסוג קלוסטרידיום פוגעים בחלבונים הנחוצים לעגינת השלפוחיות באזורים הפעילים ולאיחויין עם קרום התא הקדם-סינפטי, אך הנזק הקליני יכול להשתנות בהתאם לסוג תאי העצב המושפע מהרעלן: רעלן הטטנוס, טטנוספסמין, משתק עצבים מעכבים בעמוד השדרה שתפקידם למנוע את התכווצותם של שרירים, והתוצאה היא כיווץ שרירים בלתי רצוני. לעומת זאת, רעלני הבוטולינום, מהרעלנים החזקים ביותר בטבע, פוגעים בעצבים התנועתיים וגורמים לשיתוק השרירים. הרעלן α-Latrotoxin, המופק על ידי עכבישים ארסיים ובהם אלמנה שחורה, נקשר כנראה לאחד מהחלבונים המתווכים באיחוי השלפוחיות עם קרום התא וגורם לשחרור רצוף של מוליכים עצביים ללא תלות בכניסת סידן לתא. האות העצבי הרצוף בעצבים תנועתיים גורם לכיווץ שרירים, ואילו בעצבים תחושתיים מתבטאת תחושת כאב. רעלן נוסף, batrachotoxin, המופק על ידי מספר מיני צפרדעים בדרום אמריקה ומשמש כאחד הרעלים בחיצי האינדיאנים, פוגע במעבר שלפוחיות נוירופפטידים מגוף התא אל הטרמינל.
התרופה רזרפין (Reserpine), נקשרת באופן בלתי הפיך לאחד מחלבוני ההעברה של שלפוחיות סינפטיות של מוליכים עצביים מונואמיניים - ביניהם נוראפינפרין, דופמין, וסרוטונין. חסימת החלבון, החיוני לאגירת מוליכים עצביים אלה בשלפוחיות הסינפטיות, מקטינה את יכולת התא לשחרר מוליך עצבי. במערכת העצבים הסימפתטית מצמצמת התרופה את היכולת להצר כלי דם, ולכן שימשה במקורה כתרופה נגד יתר לחץ דם. השימוש בה כתרופה מדכאת או אנטיפסיכוטית נובע מהשפעתה על נוראפינפרין, דופאמין וסרוטונין במוח, והחל לאחר שחולים שטופלו נגד יתר לחץ דם סבלו מדיכאון כתופעת לוואי. לתרופה השפעה מדכאת במינונים גבוהים, אך במינונים נמוכים היא דווקא עשויה לשמש כתרופה נוגדת דיכאון[דרוש מקור].
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- Kandel, E.R.; Schwartz, J.H., Jessell, T.M. (2000). Principles of Neural Science, 4th ed.. New York: McGraw-Hill, 269-273
- Purves, D.; Augustine, G.J.; Fitzpatrick, D.; Katz, L.C.; LaMantia, A.S.; McNamara, J.O.; Williams, S.M. (2001). Neuroscience, 2nd ed. . Sunderland (MA): Sinauer Associates, Inc.
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.