Wnt proteini
Wnt proteini uključuju obitelj od 19 lipidno modificiranih signalnih molekula koje se izlučuju kako bi koordinirali i utjecali na razne biološke i razvojne procese u stanici.[1][2] Njihovo ime Wnt dolazi od Wg (wingless – beskrilno) i Int (integration), stoga označava beskrilno integracijsko mjesto (Wingless-related integration site).[3] Ovi proteini sadržavaju otprilike od 350 do 400 aminokiselina, a njihovo je najvažnije svojstvo 22 cisteinskih ostataka koji tvore disulfidne mostove i održavaju sekundarnu strukturu proteina.[1][4]
Povijest Wnt proteina započela je genetikom miša i vinske mušice Drosophile melanogaster. Prvo otkriće fenotipa povezanog s Wnt-om može se pratiti unazad do 1936. godine, kada su Thomas Hunt Morgan i kolege opisali mutanta Drosophile sa zastakljenim očima. 1970-ih godina znanstvenici u Indiji otkrili su muhe bez krila (Sharma, 1973; Sharma i Chopra, 1976). Godine 1980. Nüsslein-Volhard i Wieschaus ponovno su otkrili wg kao podklasu gena koji utječe na polaritet unutar pojedinih segmenata tijela muhe.[3] Godine 1982. Nusse i Varmus otkrili su onkogen int1 kod miševa (integracija 1).[1][3] Tek 1987. Cabrera i Rijsewijk prepoznali su int1 kao mišji homolog Drosophila wg gena, a 1990-ih uspostavljena je nomenklatura Wnt (engl. wingless integration site). Godine 2012. Janda i suradnici pročistili su XWnt8/Fz8-CRD kompleks gel filtracijskom kromatografijom,[2][3] a zatim su kristalizirali kompleks i upotrijebili rendgensku kristalografiju kako bi dobili strukturu proteina, rezolucije 3,25 angstroma.[2]
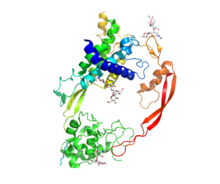
Wnt proteini sastoje se 2 glavne domene: veće amino N-terminalne domene (NTD) koja predstavlja palac proteina (u metafori proteina kao ruke) i karboksilne C-terminalne domene (CTD), koja predstavlja kažiprst.[2][4] NTD obuhvaća sedam alfa-zavojnica, dvoje beta-nabranih ploča i 10 cisteinskih ostataka koji tvore pet disulfidnih mostova.[1][2] Palac se proteže na palmitoleinsku kiselinu (može se zamisliti kao vrh ili nokat palca) koja se dodaje proteinu posttranskripcijski te pridonosi hidrofobnosti ovog proteina. CTD uključuje jednu alfa uzvojnicu, dvoje beta ploča i šest disulfidnih mostova, izgrađenih od 12 cisteinskih ostataka.[2][4] Na krajevima obiju domena/prsta ima mnogo cisteinskih ostataka na kojima se spaja receptor frizzled pomoću (cysteine rich domain CRD) domene bogatom cisteinskim ostacima (može se zamisliti kako oba prsta pridržavaju ovaj receptor).[1][4] Frizzled (nakovrčan) receptor je transmembranski receptor koji prolazi membranu sedam puta i nužan je za Wnt signalizaciju.[2] Postoje 10 ljudskih frizzled receptora.[3] Regija između amino i karboksilne domene (palca i kažiprsta) koja ih ujedno i povezuje naziva se dlanom proteina i predstavlja regiju najveće fleksibilnosti.[1]
Wnt su izvanstanični proteini. U endoplazmatskom retikulumu, prolaze proces acilacije kataliziran aciltransferazom PORCN (engl. Porcupine). Novonastali Wnt lipoproteini se transportiraju u Golgijev aparat (GA) gdje se vežu za WLS receptore koji služe kao šaperoni za usmjeravanje Wnt proteina u izvanstanični prostor.[5]
Izvanstanični Wnt aktiviraju signalne puteve vežući se za G protein-vezani receptor frizzled (FZD).[5][6] Aktivacija tog receptora dovodi do regulacije stanične proliferacije, diferencijacije, motilnosti, polarnosti i apoptoze.
Wnt reguliraju diferencijaciju tkiva tako što utječu na razvoj matičnih stanica u embrionalnom razvoju (embriogenezi) i održavanju homeostaze odraslih tkiva (npr. održavanje homeostaze koštanog tkiva povećavajući stvaranje osteoblasta iz mezenhimalnih progenitorskih stanica).[7]
Najpoznatiji signalni put je Wnt/β-katenin. Vezanje Wnt na FZD uzrokuje regrutaciju DVL proteina (engl. dishevelled) koji uzrokuje inhibiciju kompleksa uništenja (engl. destruction complex) koji u konačnici uzrokuje nakupljanje β-katenina u citosolu. β-katenin se translocira u jezgru i aktivira transkripcijski faktor TCF te uzrokuje ekspresiju ciljnih gena.[5]
Wnt/JNK put se aktivira interakcijom Wnt-FZD i posljedičnom aktivacijom malih GTP-aza RAC1 i RHOA koje imaju ulogu u regulaciji aktinskog citoskeleta, ali i aktiviraju JNK koja fosforilira i aktivira c-JUN koji utječe na ekspresiju gena.
Wnt aktiviraju Ca²+ signalni put. DVL aktivira fosfolipazu C te uzrokuje stvaranje IP3 molekule koja dovodi do nakupljanja Ca²+ iona u citosolu. Ca²+ ioni u konačnici dovode do aktivacije NFAT transkripcijskog faktora koji utječe na ekspresiju gena.[5]
Najučestalija bolest kod koje se pronalaze razne dizregulacije Wnt puta je rak. Uska povezanost poremećaja u Wnt putu s rizikom od nastanka raka najviše je proučavana kod kolorektalnog karcinoma (rak debelog crijeva), kod kojeg je učestalost pojave poremećenog funkcioniranja Wnt puta preko 50%. Većina je rezultat mutacija u APC genu, čija su oba alela inaktivirana. Kolorektalni rak nastaje i kao posljedica mutacija u AXIN genima i β-catenina na signalnom putu Wnt proteina.[8]
Ostali primjeri uključuju mutacije u spolnim stanicama APC gena koje rezultiraju nastankom obiteljske adenomatozne polipoze, te još jedan vrlo česti primjer – hepatocelularni karcinom kao posljedica mutacije AXIN1 gena.[9][10]
Indirektno, Wnt proteini također mogu doprinositi metastatskom širenju karcinoma na način da potiču imunosupresiju mikrookoliša.[11]
Wnt signalni put ima značajnu ulogu u razvoju krvožilnih bolesti, budući da regulira formaciju srca i krvnih žila putem uključenosti u procese diferencijacije i specifikacije srčanih progenitorskih stanica. Osim toga, ključan je za održavanje homeostaze u srčanom tkivu. Otkriveno je da abnormalna aktivacija Wnt/β-katenin puta može rezultirati fibroznim odgovorom i patološkim remodeliranjem srčanog tkiva.[12]
Genetske promjene u kontekstu gena koji kodiraju za Wnt proteine povezane su s raznim bolestima, kao što su razvojni poremećaji te kožne i neuronske bolesti.
Besmislena mutacija Wnt3 gena uzrokuje Tetra-Amelija sindrom, dok su prekomjerne ekspresije Wnt4 i Wnt11 uočene u miševa s policističnom bolesti bubrega.[13]
Mutacije gubitka funkcije LRP5, receptora povezanim s Wnt signalnim putem, uključene su u patogenezu sindroma osteoporoze-pseudoglioma (OPPG) i obiteljske eksudativne vitreoretinopatije (FEVR).
U bolesti kože, specifičnije Dupuytrenovoj bolesti, uočene su povišene razine signalizacije β-katenina.
Kod neuronskih bolesti, povećana ekspresija Wnt1 negativno utječe na plastičnost mozga oboljelih od shizofrenije. Također, gubitak funkcije Wnt/β-katenin puta povezan je s Alzheimerovom bolesti.[13]
- ↑ a b c d e f Willert, K.; Nusse, R. 1. rujna 2012. Wnt Proteins. Cold Spring Harbor Perspectives in Biology (engleski). 4 (9): a007864–a007864. doi:10.1101/cshperspect.a007864. ISSN 1943-0264. PMC 3428774. PMID 22952392CS1 održavanje: format PMC-a (link)
- ↑ a b c d e f g Janda, Claudia Y.; Waghray, Deepa; Levin, Aron M.; Thomas, Christoph; Garcia, K. Christopher. 6. srpnja 2012. Structural Basis of Wnt Recognition by Frizzled. Science (engleski). 337 (6090): 59–64. doi:10.1126/science.1222879. ISSN 0036-8075. PMC 3577348. PMID 22653731CS1 održavanje: format PMC-a (link)
- ↑ a b c d e Wiese, Katrin E.; Nusse, Roel; van Amerongen, Renée. 15. lipnja 2018. Wnt signalling: conquering complexity. Development (engleski). 145 (12). doi:10.1242/dev.165902. ISSN 1477-9129
- ↑ a b c d Takada, Shinji; Fujimori, Sayumi; Shinozuka, Takuma; Takada, Ritsuko; Mii, Yusuke. Siječanj 2017. Differences in the secretion and transport of Wnt proteins. Journal of Biochemistry (engleski). 161 (1): 1–7. doi:10.1093/jb/mvw071. ISSN 0021-924X
- ↑ a b c d Ljungberg, Johanna K.; Kling, Jessica C.; Tran, Thao Thanh; Blumenthal, Antje. 8. studenoga 2019. Functions of the WNT Signaling Network in Shaping Host Responses to Infection. Frontiers in Immunology (engleski). 10. doi:10.3389/fimmu.2019.02521. ISSN 1664-3224. PMC 6857519. PMID 31781093CS1 održavanje: format PMC-a (link)
- ↑ Schulte, Gunnar; Bryja, Vítězslav. Listopad 2007. The Frizzled family of unconventional G-protein-coupled receptors. Trends in Pharmacological Sciences. 28 (10): 518–525. doi:10.1016/j.tips.2007.09.001. ISSN 0165-6147
- ↑ Steinhart, Zachary; Angers, Stephane. 1. lipnja 2018. Wnt signaling in development and tissue homeostasis. Development. 145 (11). doi:10.1242/dev.146589. ISSN 1477-9129
- ↑ Zhan, T; Rindtorff, N; Boutros, M. Ožujak 2017. Wnt signaling in cancer. Oncogene (engleski). 36 (11): 1461–1473. doi:10.1038/onc.2016.304. ISSN 0950-9232. PMC 5357762. PMID 27617575CS1 održavanje: format PMC-a (link)
- ↑ Clevers, Hans; Nusse, Roel. Lipanj 2012. Wnt/β-Catenin Signaling and Disease. Cell. 149 (6): 1192–1205. doi:10.1016/j.cell.2012.05.012. ISSN 0092-8674
- ↑ Satoh, Seiji; Daigo, Yataro; Furukawa, Yoichi; Kato, Tatsushi; Miwa, Nobutomo; Nishiwaki, Tadashi; Kawasoe, Teru; Ishiguro, Hideyuki; Fujita, Manabu; Tokino, Takashi; Sasaki, Yo. Ožujak 2000. AXIN1 mutations in hepatocellular carcinomas, and growth suppression in cancer cells by virus-mediated transfer of AXIN1. Nature Genetics (engleski). 24 (3): 245–250. doi:10.1038/73448. ISSN 1061-4036
- ↑ Parsons, Marie J.; Tammela, Tuomas; Dow, Lukas E. 1. listopada 2021. WNT as a Driver and Dependency in Cancer. Cancer Discovery (engleski). 11 (10): 2413–2429. doi:10.1158/2159-8290.CD-21-0190. ISSN 2159-8274
- ↑ Foulquier, Sébastien; Daskalopoulos, Evangelos P.; Lluri, Gentian; Hermans, Kevin C. M.; Deb, Arjun; Blankesteijn, W. Matthijs. 1. siječnja 2018. Michel, Martin C. (ur.). WNT Signaling in Cardiac and Vascular Disease. Pharmacological Reviews (engleski). 70 (1): 68–141. doi:10.1124/pr.117.013896. ISSN 0031-6997. PMC 6040091. PMID 29247129CS1 održavanje: format PMC-a (link)
- ↑ a b Luo, Jinyong; Chen, Jin; Deng, Zhong-Liang; Luo, Xiaoji; Song, Wen-Xin; Sharff, Katie A; Tang, Ni; Haydon, Rex C; Luu, Hue H; He, Tong-Chuan. Veljača 2007. Wnt signaling and human diseases: what are the therapeutic implications?. Laboratory Investigation. 87 (2): 97–103. doi:10.1038/labinvest.3700509. ISSN 0023-6837