Dietil-malonát
| Dietil-malonát | |||

| |||

| |||
| Más nevek | dietil-malonát | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | DEM | ||
| CAS-szám | 105-53-3 | ||
| PubChem | 7761 | ||
| ChemSpider | 13863636 | ||
| EINECS-szám | 203-305-9 | ||
| MeSH | Diethyl+malonate | ||
| ChEBI | 391281 | ||
| RTECS szám | OO0700000 | ||
| |||
| |||
| InChIKey | IYXGSMUGOJNHAZ-UHFFFAOYSA-N | ||
| Beilstein | 774687 | ||
| UNII | 53A58PA183 | ||
| ChEMBL | 177114 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C7H12O4 | ||
| Moláris tömeg | 160,17 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Sűrűség | 1,05 g/cm³, folyadék | ||
| Olvadáspont | −50 °C | ||
| Forráspont | 199 °C | ||
| Oldhatóság (vízben) | elhanyagolható | ||
| Savasság (pKa) | 14 | ||
| Mágneses szuszceptibilitás | −92,6·10−6 cm³/mol | ||
| Veszélyek | |||
| Főbb veszélyek | ártalmas (X), gyúlékony (F) | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A dietil-malonát színtelen, almára emlékeztető szagú folyadék, a malonsav dietil észtere. A természetben előfordul a szőlőben és az eperben. Felhasználják parfümökben, illetve más vegyületek – például barbiturátok, mesterséges aromák, a B1- és B6-vitamin – szintéziséhez.
Szerkezete és tulajdonságai
[szerkesztés]A malonsav egyszerű dikarbonsav, melyben a két karboxilcsoport egymáshoz közel helyezkedik el. A dietil-malonát malonsavból történő keletkezése során mindkét karboxilcsoport hidroxilcsoportja (−OH) helyébe etoxicsoport (−OEt; −OCH2CH3) lép. A molekula közepén található metiléncsoportnak (−CH2−) két karbonilcsoport (−C(=O)−) szomszédja van.[1]
A karbonilcsoport melletti szénatomhoz kapcsolódó hidrogének lényegesen (akár 30 nagyságrenddel savasabbak, mint az alkilcsoport melletti hidrogének. (Ez a karbonilhoz képesti úgynevezett α pozíció.) A két szomszédos karbonilcsoporttal rendelkező szénatomhoz kapcsolódó hidrogén még savasabb, mert a karbonilcsoportok segítik stabilizálni a karbaniont, mely a köztük lévő metiléncsoportról egy proton eltávolításával keletkezik.
E vegyület konjugált bázisában a rezonancia stabilizáció mértékét az alábbi három rezonancia forma mutatja:
Előállítása
[szerkesztés]Klórecetsav nátrium sójának nátrium-cianiddal történő reakciójával, majd a kapott nitril bázikus hidrolízisével nyerhető a malonsav nátrium sója, melynek Fischer-féle észteresítésével dietil-malonát keletkezik:
Reakciói
[szerkesztés]Malonészter szintézis
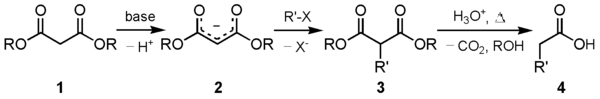
[szerkesztés]A dietil-malonát egyik fő felhasználása a malonészter szintézis. A dietil-malonátból (1) megfelelő bázissal karbanion (2) képződik, mely megfelelő elektrofillel alkilezhető. Az alkilezett 1,3-dikarbonil vegyület (3) könnyen dekarboxilezhető, szén-dioxid kilépésével szubsztituált ecetsav (4) keletkezik:
Bázisként leggyakrabban nátrium-etoxidot használnak. Vizes nátrium-hidroxid alkalmazásakor a bázikus hidrolízis termékei, nátrium-malonát és etanol keletkezhetnek. Ezzel szemben ha nátrium-etoxidot használnak, az etoxid karboxilátra történő nukleofil támadása nem eredményez mellékterméket, míg más alkoxid sók az átészteresítés miatt melléktermékeket adnának.
További reakciók
[szerkesztés]Sok más észterhez hasonlóan ez a vegyület is Claisen-kondenzációs reakcióba vihető. A dietil-malonát előnye, hogy a nemkívánatos önkondenzációs reakció nem lép fel. Más észterekhez hasonlóan az alfa-pozícióban brómozható.[2]
Feleslegben levő nátrium-nitrittel ecetsavban nitrozálható, a kapott dietil-oximinomalonát etanolban, Pd/C katalizátor mellett végzett katalitikus hidrogenolízisével dietil-aminomalonát (DEAM) keletkezik. A DEAM-ból acetilezéssel dietil-acetamidomalonát állítható elő (melyet aminosavak szintéziséhez lehet használni), vagy 3-szubsztituált 2,4-diketonokkal forrásban lévő ecetsavra lehet addícionálni, így jó kitermeléssel különbözőképpen szubsztituált etil-pirrol-2-karboxilátok állíthatók elő, melyek porfirin-szintézishez használhatók fel.[3]
Hivatkozások
[szerkesztés]- ↑ IR spectrum of Malonic acid. [2010. június 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. szeptember 2.)
- ↑ C. S. Palmer and P. W. McWherter. „Ethyl Bromomalonate”. Org. Synth..; Coll. Vol. 1: 245
- ↑ (1985. 12) „Pyrrole chemistry. An improved synthesis of ethyl pyrrole-2-carboxylate esters from diethyl aminomalonate” (angol nyelven). The Journal of Organic Chemistry 50 (26), 5598–5604. o. DOI:10.1021/jo00350a033. (Hozzáférés: 2018. szeptember 2.)
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Diethyl malonate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.