MyoD
| miogén differenciáció 1 | |
| Azonosítók | |
| Jel | MYOD1, MYF3 |
| HGNC | 7611 |
| Entrez | 4654 |
| OMIM | 159970 |
| RefSeq | NM_002478 |
| UniProt | P15172 |
| Egyéb adatok | |
| Lokusz | 11. krom. p15.1 |
A MyoD, más néven mioblasztdeterminációs protein 1[1] az izomdifferenciációt szabályzó fehérje. A Harold M. Weintraub laboratóriumában felfedezett MyoD[2] a miogén szabályzó faktorok (MRF) közé tartozik.[3] E bHLH (bázikus hélix-gyűrű-hélix) transzkripciós faktorok a miogén differenciációban szekvenciálisan hatnak. Gerinces-MRF-ek például a MyoD1, a Myf5, a miogenin és az MRF4 (Myf6). Gerinctelenekben általában egy MyoD fehérje található.
A MyoD a miogénné válás egyik első markere. A MyoD-t a kvieszcens szatellitsejtek igen alacsony, gyakorlatilag észlelhetetlen mennyiségben expresszálják, edzéskor vagy izomszövet-sérüléskor aktiválódik az expresszió. A MyoD hatása a szatellitsejtekre dózisfüggő: a magas MyoD-expresszió akadályozza a sejt megújulását, elindítja a terminális differenciációt, és apoptózist okozhat. Bár a MyoD a mioblaszttá válást jelzi, az izomfejlődés nem tér el jelentősen MyoD-hiányos egérmutánsokban. Ez valószínűleg a Myf5 vagy az Mrf4 funkciós redundanciája miatt van. Azonban a sikeres miogenezishez a MyoD és a Myf5 is szükséges.[4][5]
Története
[szerkesztés]A MyoD-t Davis, Weintraub és Lassar klónozták 1987-ben a Cellben megjelent, az izomképzésről szóló funkcionális assayben. 1988-ban Tapscott, Davis, Thayer, Cheng, Weintraub és Lassar magi foszfoproteinként írták le a Science-ben. A kutatók expresszálták az egér MyoD-jének komplementer DNS-ében (cDNS) különböző sejtvonalakban (fibroblaszt és adipoblaszt), azt találták, hogy a MyoD ezeket miogén sejtekké alakította.[2][6] 1989-ben több kísérletet végeztek a fehérje szerkezetének és funkciójának meghatározására, megerősítve az eredeti feltételezést, miszerint a fehérje aktív helye a dimerizációhoz hélix-gyűrű-hélix (bHLH) és egy ez előtti bázikus hely csak a fehérjedimerré válás után segítette a DNS-kötést.[7] A MyoD továbbra is aktív kutatási terület, mivel még mindig kevés ismeret van a funkciója sok részéről.
Funkció
[szerkesztés]A MyoD feladata a fejlődésben a mesodermalis sejtek mioblaszttá alakítása, majd ennek szabályzása. A MyoD szabályozhatja továbbá az izomjavítást is. A MyoD-mRNS-szint az idősödő vázizomszövetben magasabb.
A MyoD fő funkciója továbbá a sejtek kilépése a sejtciklusból (sejtproliferáció leállítása a differenciált miocitákban) a p21- és miogenintranszkripció növelésével. A MyoD-t gátolják a ciklindependens kinázok (CDK), ezeket pedig a p21 gátolja. Így a MyoD előrecsatolással erősíti hatását.
Hosszútávú MyoD-expresszió kell az izomhoz kapcsolódó gének expressziójának fenntartásához.[8]
A MyoD fontos effektora a gyorsan összehúzódó izomszövet (IIA, IIX és IIB) fenotípusának.[9][10]
Mechanizmusai
[szerkesztés]A MyoD transzkripciós faktor, és irányíthatja a kromatin-újramodellezést az E-boxhoz kötődve. A MyoD több száz izomgénpromoterhez tud kötni, és lehetővé teszi a mioblasztproliferációt. Bár nem teljesen tisztázott, a MyoD feltehetően fontos miogenezis-irányító a KAP1 (KRAB (Krüppel-szerű asszociált box)-asszociált protein 1) foszforilációja által mediált be/kikapcsoló asszociációval.[11] Ez izomhoz kapcsolódó géneknél található a mioblasztokban a MyoD-vel és a Mef2-vel (miocita-erősítő faktor 2). Itt támasztó funkciót tölt be, és aktiválja a p300-at és az LSD1-et több korepresszorral, például a G9a-val és a hiszton-deacetiláz 1-gyel (HDAC1) együtt. Ez az izomgének promotereit csendesíti. Mikor az MSK1 kináz foszforilálja a KAP1-et, a korábban kötött korepresszorok felszabadulnak, lehetővé téve a MyoD-nek és a Mef2-nek a transzkripció aktiválását.[12]
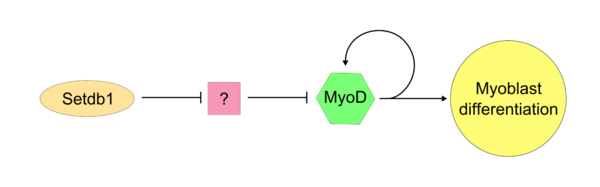
Miután a főirányító MyoD aktív lett, a SETDB1 szükséges annak expressziójának fenntartásához a sejtben. A Setdb1 szükséges a MyoD és izomspecifikus gének expressziójának fenntartásához, mivel a Setdb1-expresszió csökkenése súlyosan késlelteti a mioblasztdifferenciációt és -determinációt.[13] Exogén MyoD-vel kezelt Setdb1-hiányos mioblasztok differenciációja helyreáll. A Setdb1 MyoD-re gyakorolt hatásának egy modelljében a Setdb1 egy MyoD-inhibitort gátol. Ez kompetitíven hat a MyoD ellen az általános sejtproliferációban. E modell bizonyítéka, hogy a Setdb1 csökkenése közvetlenül gátolja a mioblasztdifferenciációt, melyet az ismeretlen MyoD-inhibitor okozhat.
A MyoD ezenkívül együttműködik a tumorszupresszorgén Retinoblastomával (pRb) a terminálisan differenciált mioblasztok sejtciklusának leállításában.[14] Ezt a ciklin D1 szabályzásával éri el. A sejtciklus leállása (mely mioblasztok esetén a miogenezis végét jelenti) függ a ciklin D1 folytonos és stabil gátlásától. A MyoD és a pRb is szükségesek a ciklin D1 repressziójához, de nem közvetlenül a ciklin D1-re hatnak, hanem a Fra-1-re, mely a ciklin D1 előtt van nem sokkal. Azért van mindkettőre szükség a Fra-1 (és így a ciklin D1) gátlására, mivel a MyoD és a pRb önmagukban nem elegendő a megfelelő ciklin D1-gátláshoz és így a sejtciklus leállításához. Egy Fra-1-intron erősítőjében két állandósult MyoD-kötőhely található. A MyoD és a pRb együttműködnek a Fra-1-intron erősítőjében annak gátlásában, így a ciklin D1 gátlásában is, végül a terminálisan differenciált mioblasztok sejtciklusának leállítását okozva.[15]
A Wnt-jelzés befolyásolhatja a MyoD-t
[szerkesztés]A szomszédos szövetek Wnt-jelzése indukálja aze ezeket kapó szomitasejteket a Pax3, a Pax7 és miogén szabályzófaktorok, például a Myf5 és a MyoD expressziójára. Egész pontosan a Wnt3a közvetlenül befolyásolhatja a MyoD-expressziót cisz-elem interakciókkal disztális erősítő és Wnt-válaszelem révén.[16] A dorzális velőcső Wnt1-e és a felszíni ektoderma Wnt6/Wnt7a-ja is befolyásolhatják a szomita miogenezisét, ez utóbbi feltehetően elsősorban a MyoD-n keresztül működhet.
Nyugalmi állapotban (fiziológiás stressz nélkül) lévő felnőtt izmok a Wnt5a, Wnt5b, Wnt7a és Wnt4 fehérjéket expresszálják. Izom sérülése esetén (mely regenerációt igényel) a Wnt5a-, Wnt5b- és Wnt7a-expresszió nő. Az izom regenerációjának végén megnő a Wnt7b és a Wnt3a-expresszió is. E Wnt-jelzési minta a progenitorsejtek differenciációját okozza, mely csökkenti az elérhető szatellitsejtek számát. A Wnt fontos a szatellitsejt-szabályzásban, a vázizmok öregedésében és regenerációjában. A Wnt-fehérjék aktiválják továbbá a Myf5- és MyoD-expressziót a Wnt1 és Wnt7a révén. A Wnt4, Wnt5 és Wnt6 kevéssel növelik a szabályzófaktorok szintjét. Ezenkívül a MyoD növeli a Wnt3a-szintet a mioblasztok differenciációjakor. Nem ismert, hogy a Wnt cisz-regulációval vagy közvetett fiziológiai útvonalakkal aktiválja a MyoD-t.[17]
Koaktivátorok és represszorok
[szerkesztés]IFRD1 is a positive cofactor of MyoD, as it cooperates with MyoD at inducing the transcriptional activity of MEF2C (by displacing HDAC4 from MEF2C); moreover IFRD1 also represses the transcriptional activity of NF-κB, which is known to inhibit MyoD mRNA accumulation.[18][19]
Az NFATc1 a rosttípus összetételét szabályzó transzkripciós faktor, és aerob edzés kor a gyors-lassú összehúzódású rost átmenet NFATc1-et igényel. A MyoD-expresszió fontos transzkripciós faktor a gyors összehúzódású rostokban, melyet az oxidatív rostban az NFATc1 gátol. Az NFATc1 a MyoD-t annak N-terminális aktivációs doménjével való fizikai kölcsönhatással gátolja, gátolva ezzel a p300 aktiválását. Az NFATc1 a MyoD–p300 kölcsönhatást fizikailag zavarja. Ez a rosttípusok edzéskori in vivo átmenetének mechanizmusának alapja az NFATc1 és a MyoD szerepeinek cseréjével. Az NFATc1 az egyensúlyt a lassan összehúzódó izomrostokban a MyoD fizikai gátlásával irányítja.[20]

A hiszton-deacetiltranszferáz p300 a MyoD-vel az izomcső fibroblasztokból való létrehozásához szükséges kölcsönhatásban működik. A p300 aktiválása a sebességmeghatározó lépés a fibroblasztok izomcsővé alakításában.[21] A p300-on kívül a MyoD aktiválja még a Set7, a H3K4me1, a H3K27ac és az RNAP II fehérjéket a kötött erősítővel, lehetővé téve a helyzettől függő és a MyoD-aktivitással biztosított izomgén-aktivációt. Esszenciális koaktivátorként az endogén p300 azonban szükséges a MyoD működéséhez. A MyoD asszociatívan köti az erősítő régiót helyőrző „feltételezett pionírfaktorral”, mely segíti egy adott inaktív konformációban való megőrzésüket. Az erősítőhöz kapcsolt helyőrző fehérje eltávolítása vagy inaktivációja után az erősítőaktivitást pozitívan szabályzó transzkripciós faktorok újabb csoportjának aktivációja lehetséges, transzkripcionálisan aktív állapotba hozva a MyoD–transzkripciós faktor–erősítő komplexet.
Interakciók
[szerkesztés]A MyoD interakcióba léphet az alábbi fehérjékkel:
- C-jun,[22]
- CREB-kötő protein,[23][24]
- CSRP3,[25]
- ciklindependens kináz 4,[26][27]
- ciklindependenskináz-inhibitor 1C,[28]
- EP300,[24][29]
- HDAC1,[30][31]
- ID1,[32][33][34][35][36][37]
- ID2,[33]
- MDFI,[38]
- MOS,[39]
- Retinoblastoma protein,[31][40]
- Retinoid X-receptor α[41]
- STAT3,[42] and
- TCF3.[33][43]
Jegyzetek
[szerkesztés]- ↑ P15172 (MYOD1_HUMAN). UniProtKB . (Hozzáférés: 2019. július 17.)
- ↑ a b Davis RL, Weintraub H, Lassar AB (1987. december 1.). „Expression of a single transfected cDNA converts fibroblasts to myoblasts”. Cell 51 (6), 987–1000. o. DOI:10.1016/0092-8674(87)90585-X. PMID 3690668.
- ↑ Entrez Gene: MYOD1 myogenic differentiation 1
- ↑ Rudnicki MA, Schnegelsberg PN, Stead RH, Braun T, Arnold HH, Jaenisch R (1993. december 1.). „MyoD or Myf-5 is required for the formation of skeletal muscle”. Cell 75 (7), 1351–1359. o. DOI:10.1016/0092-8674(93)90621-V. PMID 8269513.
- ↑ Hinits Y, Williams VC, Sweetman D, Donn TM, Ma TP, Moens CB, Hughes SM (2011. október 1.). „Defective cranial skeletal development, larval lethality and haploinsufficiency in Myod mutant zebrafish”. Dev. Biol. 358 (1), 102–112. o. DOI:10.1016/j.ydbio.2011.07.015. PMID 21798255. PMC 3360969.
- ↑ Tapscott SJ, Davis RL, Thayer MJ, Cheng PF, Weintraub H, Lassar AB (1988. október 1.). „MyoD1: a nuclear phosphoprotein requiring a Myc homology region to convert fibroblasts to myoblasts”. Science 242 (4877), 405–511. o. DOI:10.1126/science.3175662. PMID 3175662.
- ↑ Davis RL, Cheng PF, Lassar AB, Thayer M, Tapscott S, Weintraub H (1989). „MyoD and achaete-scute: 4-5 amino acids distinguishes myogenesis from neurogenesis”. Princess Takamatsu Symposia 20, 267–278. o. PMID 2562185.
- ↑ Fong, A (2014. október 1.). „Skeletal muscle programming and re-programming”. Current Opinion in Genetics & Development 23 (5), 568–573. o. DOI:10.1016/j.gde.2013.05.002. PMID 23756045. PMC 3775946.
- ↑ Hughes SM, Koishi K, Rudnicki M, Maggs AM (1997. január 1.). „MyoD protein is differentially accumulated in fast and slow skeletal muscle fibres and required for normal fibre type balance in rodents”. Mech Dev 61 (1–2), 151–163. o. DOI:10.1016/S0925-4773(96)00631-4. PMID 9076685.
- ↑ Ehlers ML, Celona B, Black BL (2014. szeptember 1.). „NFATc1 controls skeletal muscle fiber type and is a negative regulator of MyoD activity”. Cell Reports 8 (6), 1639–1648. o. DOI:10.1016/j.celrep.2014.08.035. PMID 25242327. PMC 4180018.
- ↑ Singh K, Cassano M, Planet E, Sebastian S, Jang SM, Sohi G, Faralli H, Choi J, Youn HD, Dilworth FJ, Trono D (2015. március 1.). „A KAP1 phosphorylation switch controls MyoD function during skeletal muscle differentiation”. Genes & Development 29 (5), 513–525. o. DOI:10.1101/gad.254532.114. PMID 25737281. PMC 4358404.
- ↑ (2014. február 1.) „Gene Regulatory Networks and Transcriptional Mechanisms that Control Myogenesis”. Developmental Cell 28 (3), 225–238. o. DOI:10.1016/j.devcel.2013.12.020. PMID 24525185.
- ↑ Song YJ, Choi JH, Lee H (2015. február 1.). „Setdb1 Is Required for Myogenic Differentiation of C2C12 Myoblast Cells via Maintenance of MyoD Expression”. Molecules and Cells 38 (4), 362–372. o. DOI:10.14348/molcells.2015.2291. PMID 25715926. PMC 4400312.
- ↑ Rajabi HN, Takahashi C, Ewen ME (2014. augusztus 1.). „Retinoblastoma protein and MyoD function together to effect the repression of Fra-1 and in turn cyclin D1 during terminal cell cycle arrest associated with myogenesis”. The Journal of Biological Chemistry 289 (34), 23417–23427. o. DOI:10.1074/jbc.M113.532572. PMID 25006242. PMC 4156083.
- ↑ (2014. május 1.) „Interactions of proliferation and differentiation signaling pathways in myogenesis”. Postepy Hig Med Dosw 68, 516–526. o. DOI:10.5604/17322693.1101617. PMID 24864103.
- ↑ Pan YC, Wang XW, Teng HF, Wu YJ, Chang HC, Chen SL (2015. február 1.). „Wnt3a signal pathways activate MyoD expression by targeting cis-elements inside and outside its distal enhancer”. Bioscience Reports 35 (2), 1–12. o. DOI:10.1042/BSR20140177. PMID 25651906. PMC 4370097.
- ↑ (2014. január 1.) „Muscle satellite cell heterogeneity and self-renewal”. Frontiers in Cell and Developmental Biology 2 (1), 1. o. DOI:10.3389/fcell.2014.00001. PMID 25364710. PMC 4206996.
- ↑ Micheli L, Leonardi L, Conti F, Buanne P, Canu N, Caruso M, Tirone F (2005. március 1.). „PC4 coactivates MyoD by relieving the histone deacetylase 4-mediated inhibition of myocyte enhancer factor 2C”. Mol. Cell. Biol. 25 (6), 2242–59. o. DOI:10.1128/MCB.25.6.2242-2259.2005. PMID 15743821. PMC 1061592.
- ↑ Micheli L, Leonardi L, Conti F, Maresca G, Colazingari S, Mattei E, Lira SA, Farioli-Vecchioli S, Caruso M, Tirone F (2011. február 1.). „PC4/Tis7/IFRD1 stimulates skeletal muscle regeneration and is involved in myoblast differentiation as a regulator of MyoD and NF-kappaB”. J. Biol. Chem. 286 (7), 5691–707. o. DOI:10.1074/jbc.M110.162842. PMID 21127072. PMC 3037682.
- ↑ Ehlers ML, Celona B, Black BL (2014. szeptember 1.). „NFATc1 controls skeletal muscle fiber type and is a negative regulator of MyoD activity”. Cell Reports 8 (6), 1639–1648. o. DOI:10.1016/j.celrep.2014.08.035. PMID 25242327. PMC 4180018.
- ↑ (1997. február 1.) „Molecular mechanisms of myogenic coactivation by p300: direct interaction with the activation domain of MyoD and with the MADS box of MEF2C”. Molecular Cell Biology 17 (2), 1010–1026. o. DOI:10.1128/mcb.17.2.1010. PMID 9001254. PMC 231826.
- ↑ Bengal E, Ransone L, Scharfmann R, Dwarki VJ, Tapscott SJ, Weintraub H, Verma IM (1992. február 1.). „Functional antagonism between c-Jun and MyoD proteins: a direct physical association”. Cell 68 (3), 507–19. o. DOI:10.1016/0092-8674(92)90187-h. PMID 1310896.
- ↑ Polesskaya A, Naguibneva I, Duquet A, Bengal E, Robin P, Harel-Bellan A (2001. augusztus 1.). „Interaction between acetylated MyoD and the bromodomain of CBP and/or p300”. Mol. Cell. Biol. 21 (16), 5312–20. o. DOI:10.1128/MCB.21.16.5312-5320.2001. PMID 11463815. PMC 87255.
- ↑ a b Sartorelli V, Huang J, Hamamori Y, Kedes L (1997. február 1.). „Molecular mechanisms of myogenic coactivation by p300: direct interaction with the activation domain of MyoD and with the MADS box of MEF2C”. Mol. Cell. Biol. 17 (2), 1010–26. o. DOI:10.1128/mcb.17.2.1010. PMID 9001254. PMC 231826.
- ↑ Kong Y, Flick MJ, Kudla AJ, Konieczny SF (1997. augusztus 1.). „Muscle LIM protein promotes myogenesis by enhancing the activity of MyoD”. Mol. Cell. Biol. 17 (8), 4750–60. o. DOI:10.1128/mcb.17.8.4750. PMID 9234731. PMC 232327.
- ↑ Zhang JM, Zhao X, Wei Q, Paterson BM (1999. december 1.). „Direct inhibition of G(1) cdk kinase activity by MyoD promotes myoblast cell cycle withdrawal and terminal differentiation”. EMBO J. 18 (24), 6983–93. o. DOI:10.1093/emboj/18.24.6983. PMID 10601020. PMC 1171761.
- ↑ Zhang JM, Wei Q, Zhao X, Paterson BM (1999. február 1.). „Coupling of the cell cycle and myogenesis through the cyclin D1-dependent interaction of MyoD with cdk4”. EMBO J. 18 (4), 926–33. o. DOI:10.1093/emboj/18.4.926. PMID 10022835. PMC 1171185.
- ↑ Reynaud EG, Leibovitch MP, Tintignac LA, Pelpel K, Guillier M, Leibovitch SA (2000. június 1.). „Stabilization of MyoD by direct binding to p57(Kip2)”. J. Biol. Chem. 275 (25), 18767–76. o. DOI:10.1074/jbc.M907412199. PMID 10764802.
- ↑ Lau P, Bailey P, Dowhan DH, Muscat GE (1999. január 1.). „Exogenous expression of a dominant negative RORalpha1 vector in muscle cells impairs differentiation: RORalpha1 directly interacts with p300 and myoD”. Nucleic Acids Res. 27 (2), 411–20. o. DOI:10.1093/nar/27.2.411. PMID 9862959. PMC 148194.
- ↑ Puri PL, Iezzi S, Stiegler P, Chen TT, Schiltz RL, Muscat GE, Giordano A, Kedes L, Wang JY, Sartorelli V (2001. október 1.). „Class I histone deacetylases sequentially interact with MyoD and pRb during skeletal myogenesis”. Mol. Cell 8 (4), 885–97. o. DOI:10.1016/s1097-2765(01)00373-2. PMID 11684023.
- ↑ a b Mal A, Sturniolo M, Schiltz RL, Ghosh MK, Harter ML (2001. április 1.). „A role for histone deacetylase HDAC1 in modulating the transcriptional activity of MyoD: inhibition of the myogenic program”. EMBO J. 20 (7), 1739–53. o. DOI:10.1093/emboj/20.7.1739. PMID 11285237. PMC 145490.
- ↑ Garkavtsev I, Kozin SV, Chernova O, Xu L, Winkler F, Brown E, Barnett GH, Jain RK (2004. március 1.). „The candidate tumour suppressor protein ING4 regulates brain tumour growth and angiogenesis”. Nature 428 (6980), 328–32. o. DOI:10.1038/nature02329. PMID 15029197.
- ↑ a b c Langlands K, Yin X, Anand G, Prochownik EV (1997. augusztus 1.). „Differential interactions of Id proteins with basic-helix-loop-helix transcription factors”. J. Biol. Chem. 272 (32), 19785–93. o. DOI:10.1074/jbc.272.32.19785. PMID 9242638.
- ↑ Finkel T, Duc J, Fearon ER, Dang CV, Tomaselli GF (1993. január 1.). „Detection and modulation in vivo of helix-loop-helix protein-protein interactions”. J. Biol. Chem. 268 (1), 5–8. o. DOI:10.1016/S0021-9258(18)54105-3. PMID 8380166.
- ↑ Gupta K, Anand G, Yin X, Grove L, Prochownik EV (1998. március 1.). „Mmip1: a novel leucine zipper protein that reverses the suppressive effects of Mad family members on c-myc”. Oncogene 16 (9), 1149–59. o. DOI:10.1038/sj.onc.1201634. PMID 9528857.
- ↑ McLoughlin P, Ehler E, Carlile G, Licht JD, Schäfer BW (2002. október 1.). „The LIM-only protein DRAL/FHL2 interacts with and is a corepressor for the promyelocytic leukemia zinc finger protein”. J. Biol. Chem. 277 (40), 37045–53. o. DOI:10.1074/jbc.M203336200. PMID 12145280.
- ↑ Ling MT, Chiu YT, Lee TK, Leung SC, Fung MK, Wang X, Wong KF, Wong YC (2008. szeptember 1.). „Id-1 induces proteasome-dependent degradation of the HBX protein”. J. Mol. Biol. 382 (1), 34–43. o. DOI:10.1016/j.jmb.2007.06.020. PMID 18674781.
- ↑ Chen CM, Kraut N, Groudine M, Weintraub H (1996. szeptember 1.). „I-mf, a novel myogenic repressor, interacts with members of the MyoD family”. Cell 86 (5), 731–41. o. DOI:10.1016/s0092-8674(00)80148-8. PMID 8797820.
- ↑ Lenormand JL, Benayoun B, Guillier M, Vandromme M, Leibovitch MP, Leibovitch SA (1997. február 1.). „Mos activates myogenic differentiation by promoting heterodimerization of MyoD and E12 proteins”. Mol. Cell. Biol. 17 (2), 584–93. o. DOI:10.1128/mcb.17.2.584. PMID 9001211. PMC 231783.
- ↑ Gu W, Schneider JW, Condorelli G, Kaushal S, Mahdavi V, Nadal-Ginard B (1993. február 1.). „Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation”. Cell 72 (3), 309–24. o. DOI:10.1016/0092-8674(93)90110-c. PMID 8381715.
- ↑ Froeschlé A, Alric S, Kitzmann M, Carnac G, Auradé F, Rochette-Egly C, Bonnieu A (1998. július 1.). „Retinoic acid receptors and muscle b-HLH proteins: partners in retinoid-induced myogenesis”. Oncogene 16 (26), 3369–78. o. DOI:10.1038/sj.onc.1201894. PMID 9692544.
- ↑ Kataoka Y, Matsumura I, Ezoe S, Nakata S, Takigawa E, Sato Y, Kawasaki A, Yokota T, Nakajima K, Felsani A, Kanakura Y (2003. november 1.). „Reciprocal inhibition between MyoD and STAT3 in the regulation of growth and differentiation of myoblasts”. J. Biol. Chem. 278 (45), 44178–87. o. DOI:10.1074/jbc.M304884200. PMID 12947115.
- ↑ Maleki SJ, Royer CA, Hurlburt BK (1997. június 1.). „MyoD-E12 heterodimers and MyoD-MyoD homodimers are equally stable”. Biochemistry 36 (22), 6762–7. o. DOI:10.1021/bi970262m. PMID 9184158.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a MyoD című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- MyoD+Protein a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján