Savkloridok

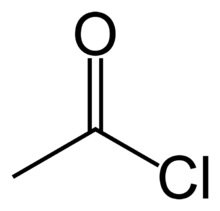
acetil-klorid vagy etanoil-klorid
A savkloridok (acil-kloridok) –CO–Cl funkciós csoportot tartalmazó szerves vegyületek. Képletüket általában RCOCl formában adják meg, ahol R az oldallánc jele. A savkloridokat a karbonsavak reaktív származékainak tekintjük. Savkloridra példa az acetil-klorid (CH3COCl). A savhalogenideken – például acetil-bromid – belül a savkloridok a legjelentősebb alcsoport.
Elnevezésük
[szerkesztés]Abban az esetben, ha a savklorid funkció a magasabb prioritású, akkor a nevet a megfelelő karbonsav nevéből képezzük, a savmaradék nevének és a -klorid utótagnak az összetételéből. Így például:
- acetil-klorid CH3COCl
- benzoil-klorid C6H5COCl
Amennyiben a vegyületben magasabb rendű funkciós csoport található, akkor a klórkarbonil- előtag használandó:[1]
- ((klórkarbonil)ecetsav) ClOCCH2COOH
Tulajdonságaik
[szerkesztés]Mivel hidrogénkötés kialakítására nem képesek, a savkloridok olvadás- és forráspontja a hasonló karbonsavakénál alacsonyabb. Az ecetsav például 118 °C-on forr, míg az acetil-klorid forráspontja 51 °C. A legtöbb karbonilvegyülethez hasonlóan infravörös spektrumukban 1750 cm−1 környékén intenzív sáv található.
Előállításuk
[szerkesztés]Ipari eljárások
[szerkesztés]Az acetil-klorid ipari előállítása az ecetsav-anhidrid hidrogén-kloriddal végzett reakciójával történik. A benzoil-kloridot a benzotriklorid részleges hidrolízisével nyerik:[2]
- C6H5CCl3 + H2O → C6H5C(O)Cl + 2HCl
Laboratóriumi módszerek
[szerkesztés]Laboratóriumban savkloridokat általában az alkil-kloridokhoz hasonlóan állítanak elő: a megfelelő hidroxicsoportot klórral helyettesítik. Ennek érdekében a karbonsavakat tionil-kloriddal, foszfor-trikloriddal vagy foszfor-pentakloriddal reagáltatják:[3]
- RCOOH + SOCl2 → RCOCl + SO2 + HCl
- 3 RCOOH + PCl3 → 3 RCOCl + H3PO3
- RCOOH + PCl5 → RCOCl + POCl3 + HCl
A tionil-kloriddal történő reakció dimetilformamiddal katalizálható.[4] Ebben a reakcióban a melléktermékként keletkező kén-dioxid és hidrogén-klorid (HCl) gáz halmazállapotúak, így távozásuk segíti a reakció végbemenetelét. A tionil-klorid (forráspontja 74,6 °C) feleslegét is könnyen el lehet távolítani.[3] A tionil-kloriddal és foszfor-pentakloriddal végzett reakció mechanizmusa hasonló, példaként a tionil-kloridos reakciót ismertetjük:[4]
Egy másik módszer oxalil-kloridot használ:
- RCOOH + ClCOCOCl → RCOCl + CO + CO2 + HCl
A reakciót dimetilformamid (DMF) katalizálja, mely az első lépésben az oxalil-kloriddal reagálva egy iminium köztitermékké alakul:
Az iminium köztitermék a karbonsavval reagálva attól elvon egy oxigénatomot, így a DMF katalizátor újraképződik.[4]
Végül ismeretesek olyan eljárások is, melyek során nem keletkezik HCl, ilyen például az Appel-reakció:[5]
- RCOOH + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl3
és a cianur-klorid (C3N3Cl3) használata:[6]
Reakcióik
[szerkesztés]Nukleofil reakciók
[szerkesztés]A savkloridok nagyon reakcióképes vegyületek. RCOOH sav megfelelőjükkel összehasonlítva őket láthatjuk, hogy míg normál körülmények között a hidroxid nem jó távozó csoport, a kloridion az, tehát már gyenge nukleofilek is megtámadják a karbonil szénatomot. Egyik általános – és gyakran kellemetlen – reakciójuk a vízzel történő karbonsavképzés:
- RCOCl + H2O → RCO2H + HCl
A savkloridok felhasználhatók karbonsavszármazékok, többek között savanhidridek, észterek és amidok előállítására, ha karbonsav sójával, alkohollal illetve aminnal reagáltatják azokat. Bázis, például vizes nátrium-hidroxid vagy piridin[3] vagy (amidok előállításakor) aminfelesleg[4] használata kívánatos a melléktermékként keletkező hidrogén-klorid eltávolításához és a reakció katalizálásához. Habár észterek vagy amidok többnyire karbonsav és alkohol vagy amin reakciójával is előállíthatók, ezek azonban megfordítható folyamatok, és sokszor a kitermelésük is alacsony. Ezzel szemben a sav-kloriddal végzett reakció (karbonsavból savklorid előállítása, majd ezek kapcsolása alkohollal vagy aminnal) gyors és irreverzibilis folyamat. Emiatt a kétlépéses reakciót gyakran előnyben részesítik az egylépéses, karbonsavat használó eljárással szemben.[3]
A savkloridok szén nukleofilekkel, például Grignard-reagenssel első lépésben általában ketont képeznek, második ekvivalens hatására tercier alkohol keletkezik. Fontos kivétel a savkloridok és bizonyos kadmiumorganikus vegyületek közötti reakció, melynél csak a keton keletkezik. A Gilman-reagenssel (lítium-rézdiorganikus vegyületek) történő nukleofil reakció – a kisebb reakciókészség miatt – is ketont eredményez. Általában az alkil származékokhoz képest az aromás karbonsavak savkloridjai kevésbé reakcióképesek, ezért csak valamivel erélyesebb körülmények között reagálnak.
A savkloridok erős hidriddonorok, például lítium-alumínium-hidrid vagy diizobutil-alumínium-hidrid hatására primer alkohollá redukálódnak. A nagyméretű ligandumot tartalmazó lítium-tri-terc-butixialumínium-hidrid a savkloridokat aldehiddé redukálja, csakúgy, mint a hidrogéngázzal mérgezett palládium katalizátor mellett végzett Rosenmund-redukció.[7]
Eleketrofil reakciók
[szerkesztés]Lewis-sav katalizátor, például vas(III)-klorid vagy alumínium-klorid jelenlétében a savkloridok Friedel–Crafts acilezési reakcióval aromás ketonná alakulnak:[3]
Az első lépésben a savklorid a Lewis-sav hatására disszociál:
Ezután az arén nukleofil megtámadja az acilcsoportot:
Végül a kloridion a kilépő protonnal HCl-t alkot, és visszaalakul az AlCl3 katalizátor:
Az erélyes reakciókörülmények és a köztitermékek reakciókészsége folytán ez az egyébként meglehetősen hasznos eljárás hajlamos mellékreakciókra, valamint az egészségre és a környezetre is káros.
Biztonsági tudnivalók
[szerkesztés]Mivel a savkloridok nagyon reakcióképes vegyületek, kezelésük során nagy gondossággal kell eljárni. Könnyfakasztó hatásúak, mivel a szem felületén található vízzel is reagálhatnak sósav és szerves sav képződése közben, melyek irritálják a szemet. Hasonló problémák léphetnek fel, ha savklorid gőzöket lélegzünk be.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben az Acyl chloride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ Nomenclature of Organic Chemistry, R-5.7.6 Acid halides
- ↑ Takao Maki, Kazuo Takeda “Benzoic Acid and Derivatives” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_555
- ↑ a b c d e Boyd, Robert W.; Morrison, Robert. Organic chemistry. Englewood Cliffs, N.J: Prentice Hall, 666–762. o. (1992). ISBN 0-13-643669-2
- ↑ a b c d Clayden, Jonathan. Organic chemistry. Oxford: Oxford University Press, 276–296. o. (2001). ISBN 0-19-850346-6
- ↑ "Triphenylphosphine-carbon tetrachloride Archiválva 2010. március 23-i dátummal a Wayback Machine-ben Taschner, Michael J. e-EROS: Encyclopedia of Reagents for Organic Synthesis, 2001
- ↑ K. Venkataraman, and D. R. Wagle (1979). „Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides”. Tet. Lett. 20 (32), 3037–3040. o. DOI:10.1016/S0040-4039(00)71006-9.
- ↑ William Reusch: Carboxylic Acid Derivatives. VirtualText of Organic Chemistry. Michigan State University. [2016. május 16-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. január 26.)






