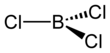
Boron triklorida
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Boron triklorida
| |||
| Nama lain
Boron(III) klorida
Trichloroborane | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| BCl3 | |||
| Massa molar | 117.17 g/mol | ||
| Penampilan | Gas tidak berwarna, asap di udara | ||
| Densitas | 1.326 g/cm3 | ||
| Titik lebur | −1.073 °C (−1.899 °F; −800 K) | ||
| Titik didih | 126 °C (259 °F; 399 K)[1] | ||
| hidrolisis | |||
| Kelarutan | dapat larut dalam CCl4, etanol | ||
| -59.9·10−6 cm3/mol | |||
| Indeks bias (nD) | 1.00139 | ||
| Struktur | |||
| Planar trigonal (D3h) | |||
| nol | |||
| Termokimia | |||
| Kapasitas kalor (C) | 107 J/mol K | ||
| Entropi molar standar (S |
206 J/mol K | ||
| Entalpi pembentukan standar (ΔfH |
-427 kJ/mol | ||
| Energi bebas Gibbs (ΔfG) | -387.2 kJ/mol | ||
| Bahaya[2] | |||
| Bahaya utama | Bisa fatal jika ditelan atau dihirup Menyebabkan luka bakar serius pada mata, kulit, mulut, paru-paru, dll Jika bereaksi dengan air akan menghasilkan HCl | ||
| Lembar data keselamatan | Templat:ICSC-small | ||
| Piktogram GHS |   
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H330, H300, H314 | |||
| Titik nyala | Tidak mudah terbakar | ||
| Senyawa terkait | |||
Anion lain
|
Boron trifluorida Boron tribromida Boron triiodida | ||
Kation lainnya
|
Aluminium klorida Galium klorida | ||
Senyawa terkait
|
Boron trioksida Karbon tetraklorida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Boron triklorida adalah senyawa anorganik dengan rumus BCl3. Gas tidak berwarna ini merupakan reagen dalam sintesis organik. Senyawa ini sangat reaktif dengan air.
Pembuatan
[sunting | sunting sumber]Boron bereaksi dengan unsur halogen untuk menghasilkan trihalida yang dibutuhkan. Namun, boron triklorida diproduksi secara industrial dengan mengklorinasi boron oksida dan karbon pada suhu 500 °C.
- B2O3 + 3 C + 3 Cl2 → 2 BCl3 + 3 CO
Reaksi karbotermik ini mirip dengan proses Kroll yang mengubah titanium dioksida menjadi titanium tetraklorida.
Reaksi
[sunting | sunting sumber]BCl3 mudah mengalami hidrolisis yang menghasilkan asam klorida dan asam borat:
- BCl3 + 3 H2O → B(OH)3 + 3 HCl
Bacaan lanjut
[sunting | sunting sumber]- Martin, D. R. (1944). "Coordination Compounds of Boron Trichloride. I. - A Review". Chemical Reviews. 34 (3): 461–473. doi:10.1021/cr60109a005.
- Kabalka, G. W.; Wu, Z. Z.; Ju, Y. H. (2003). "The Use of Organoboron Chlorides and Bromides in Organic Synthesis". Journal of Organometallic Chemistry. 680 (1–2): 12–22. doi:10.1016/S0022-328X(03)00209-2.
Referensi
[sunting | sunting sumber]- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaEROS - ^ Templat:CLP Regulation