Kalsium laktat
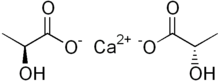
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
Kalsium bis(2-hidroksipropanoat) | |
Nama lain
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C6H10CaO6 | |
| Massa molar | 218.22 g/mol |
| Penampilan | bubuk putih atau putih pucat, sedikit bermekaran |
| Densitas | 1.494 g/cm3 |
| Titik lebur | 240 °C (464 °F; 513 K) (anhidrat) 120 °C (pentahidrat) |
| L-laktat, anhidrat, g/100 mL: 4,8 (10 °C), 5,8 (20 °C), 6,7 (25 °C), 8,5 (30 °C);[1][2] 7,9 g/100 mL (30 °C)[butuh rujukan] | |
| Kelarutan | sangat larut dalam metanol, tidak larut dalam etanol |
| Keasaman (pKa) | 6,0-8,5 |
| Indeks bias (nD) | 1.470 |
| Farmakologi | |
| Kode ATC | A12 |
| Bahaya | |
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H319 | |
| P264, P280, P305+351+338, P337+313 | |
| Titik nyala | Tidak dapat diterapkan |
| Tidak ada data | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kalsium laktat adalah garam kristal putih dengan formula C6H10CaO6, terdiri dari dua anion asam laktat H3C(CHOH)CO−2 untuk setiap kation kalsium Ca2+. Ia membentuk beberapa hidrat, yang paling umum adalah pentahidrat C6H10CaO6·5H2O.
Kalsium laktat digunakan dalam pengobatan (terutama untuk mengobati hipokalsemia), dan sebagai bahan tambahan makanan dengan nomor E E327. Beberapa kristal keju mengandung kalsium laktat.[3][4]
Sifat
[sunting | sunting sumber]Ion laktat berbentuk kiral, dengan dua enantiomer, D (−,R) dan L (+,S). Isomer L adalah isomer yang biasanya disintesis dan dimetabolisme oleh organisme hidup, namun beberapa bakteri dapat menghasilkan bentuk D atau mengubah L menjadi D. Jadi kalsium laktat juga memiliki isomer D dan L, yang semua anionnya bertipe sama.[5]
Beberapa proses sintesis menghasilkan campuran keduanya dalam jumlah yang sama, menghasilkan garam DL (campuran rasemat). Baik bentuk L maupun DL muncul sebagai kristal pada permukaan keju Cheddar yang menua.[5]
Kelarutan kalsium L-laktat dalam air meningkat secara signifikan dengan adanya ion d-glukonat, dari 6,7 g/dl) pada 25 °C menjadi 9.74 g/dl atau lebih.[1][2] Paradoksnya, meskipun kelarutan kalsium L-laktat meningkat seiring dengan peningkatan suhu dari 10 °C (4,8 g/dl) hingga 30 °C (8,5 g/dl), konsentrasi Ca2+ bebas ion berkurang hampir setengahnya. Hal ini dijelaskan karena ion laktat dan kalsium menjadi kurang terhidrasi dan membentuk kompleks C3H5O3Ca+.[2]
Bentuk garam DL (rasemat) jauh lebih sulit larut dalam air dibandingkan isomer L atau D murni, sehingga larutan yang mengandung sedikitnya 25% bentuk D akan mengendapkan kristal DL-laktat rasemat, bukan L-laktat.[6]
Pentahidrat kehilangan air di atmosfer kering antara 35 dan 135 °C, tereduksi menjadi bentuk anhidrat dan kehilangan karakter kristalnya. Prosesnya dibalik pada suhu 25 °C dan kelembapan relatif 75%.[7]
Preparasi
[sunting | sunting sumber]Kalsium laktat dapat dibuat melalui reaksi asam laktat dengan kalsium karbonat atau kalsium hidroksida.
Sejak abad ke-19, garam telah diperoleh secara industri melalui fermentasi karbohidrat dengan adanya sumber mineral kalsium seperti kalsium karbonat atau kalsium hidroksida.[8][9][10] Fermentasi dapat menghasilkan D atau L laktat, atau campuran rasemat keduanya, bergantung pada jenis organisme yang digunakan.[11]
Kegunaan
[sunting | sunting sumber]Medis
[sunting | sunting sumber]Kalsium laktat memiliki beberapa kegunaan dalam pengobatan hewan dan manusia.
Kalsium laktat digunakan dalam pengobatan sebagai antasida.[12]
Senyawa ini juga digunakan untuk mengobati hipokalsemia (kekurangan kalsium). Dapat diserap pada berbagai pH, sehingga tidak perlu dikonsumsi bersama makanan. Namun, dalam penggunaan ini ternyata kurang nyaman dibandingkan kalsium sitrat. Kalsium laktat mengandung 13% unsur kalsium.[13]
Pada awal abad ke-20, pemberian kalsium laktat oral yang dilarutkan dalam air (tetapi tidak dalam susu atau tablet) terbukti efektif dalam pencegahan tetani pada manusia dan anjing dengan insufisiensi kelenjar paratiroid atau yang menjalani paratiroidektomi.[14][15]
Senyawa ini juga ditemukan di beberapa obat kumur dan pasta gigi sebagai zat anti karang gigi.[12]
Kalsium laktat (atau garam kalsium lainnya) adalah penangkal konsumsi fluorida larut [16] dan asam fluorida.
Industri makanan
[sunting | sunting sumber]Senyawa ini adalah bahan tambahan makanan yang diklasifikasikan oleh Badan Pengawas Obat dan Makanan Amerika Serikat sebagai umumnya diakui aman (GRAS), untuk digunakan sebagai bahan pengencang, penambah rasa atau bahan penyedap rasa, bahan pengembang, suplemen nutrisi, serta penstabil dan bahan pengental.[17]
Kalsium laktat juga dikenal sebagai keju laktat karena dapat mengentalkan susu, sehingga chhena digunakan dalam produksi keju paneer.[12] Chhena juga digunakan untuk membuat berbagai manisan dan protein susu lainnya.
Kalsium laktat merupakan bahan dalam beberapa bubuk pengembang yang mengandung asam natrium pirofosfat. Ini menyediakan kalsium untuk menunda ragi.[18]
Kalsium laktat ditambahkan ke makanan bebas gula untuk mencegah karies gigi. Ketika ditambahkan ke permen karet yang mengandung silitol, senyawa ini meningkatkan remineralisasi enamel gigi.[19]
Senyawa ini juga ditambahkan pada buah-buahan yang baru dipotong, seperti blewah, untuk menjaganya tetap kencang dan memperpanjang umur simpannya, tanpa rasa pahit yang disebabkan oleh kalsium klorida, yang juga dapat digunakan untuk tujuan ini.[20]
Kalsium laktat digunakan dalam gastronomi molekuler sebagai zat yang larut dalam lemak tanpa rasa untuk sperifikasi biasa dan terbalik. Senyawa ini bereaksi dengan natrium alginat untuk membentuk kulit di sekitar makanan.
Pakan hewan
[sunting | sunting sumber]Kalsium laktat dapat ditambahkan ke pakan hewan sebagai sumber kalsium.[21]
Kimia
[sunting | sunting sumber]Senyawa ini sebelumnya merupakan zat antara dalam pembuatan asam laktat untuk makanan dan keperluan medis. Asam tidak murni dari berbagai sumber diubah menjadi kalsium laktat, dimurnikan dengan kristalisasi, dan kemudian diubah kembali menjadi asam melalui perlakuan dengan asam sulfat, yang mengendapkan kalsium sebagai kalsium sulfat. Metode ini menghasilkan produk yang lebih murni daripada yang diperoleh melalui penyulingan asam asli.[8] Baru-baru ini amonium laktat telah digunakan sebagai alternatif pengganti kalsium dalam proses ini.[10]
Pengolahan Air
[sunting | sunting sumber]Kalsium laktat telah dianggap sebagai koagulan untuk menghilangkan padatan tersuspensi dari air, sebagai alternatif terbarukan, tidak beracun, dan dapat terurai secara hayati dibandingkan aluminium klorida.[22]
Biobeton
[sunting | sunting sumber]Penambahan kalsium laktat secara substansial meningkatkan kekuatan tekan dan mengurangi permeabilitas air biobeton, dengan memungkinkan bakteri seperti Enterococcus faecalis, Bacillus cohnii, Bacillus pseudofirmus, dan Sporosarcina pasteurii menghasilkan lebih banyak kalsit.[23][24]
Referensi
[sunting | sunting sumber]- ^ a b Martina Vavrusova, Merete Bøgelund Munk, and Leif H. Skibsted (2013): "Aqueous Solubility of Calcium l-Lactate, Calcium d-Gluconate, and Calcium d-Lactobionate: Importance of Complex Formation for Solubility Increase by Hydroxycarboxylate Mixtures". Journal of Agriculture and Food Chemistry, volume 61 issue 34, pages 8207–8214. DOI:10.1021/jf402124n
- ^ a b c Martina Vavrusova, Ran Liang, and Leif H. Skibsted (2014): "Thermodynamics of Dissolution of Calcium Hydroxycarboxylates in Water". Journal of Agriculture and Food Chemistry, volume 62, issue 24, pages 5675–5681. DOI:10.1021/jf501453c
- ^ Stephie Clark; Shantanu Agarwal (April 27, 2007). "Chapter 24: Cheddar and Related Hard Cheeses. 24.6: Crystal Formation". Dalam Y. H. Hui. Handbook of Food Products Manufacturing (edisi ke-1st). Wiley-Interscience. hlm. 589. ISBN 978-0470049648.
- ^ Phadungath, Chanokphat (2011). The Efficacy of Sodium Gluconate as a Calcium Lactate Crystal Inhibitor in Cheddar Cheese (Tesis). University of Minnesota. http://purl.umn.edu/116278. Diakses pada October 12, 2013.
- ^ a b G.F. Tansman, P.S. Kindstedt, J.M. Hughes (2014): "Powder X-ray diffraction can differentiate between enantiomeric variants of calcium lactate pentahydrate crystal in cheese". Journal of Dairy Science, volume 97, issue 12, pages 7354–7362. DOI:10.3168/jds.2014-8277
- ^ Gil Fils Tansman (2014): Exploring the nature of crystals in cheese through X-ray diffraction Masters Dissertation, University of Vermont
- ^ Yukoh Sakata, Sumihiro Shiraishi, Makoto Otsuka (2005): "Characterization of dehydration and hydration behavior of calcium lactate pentahydrate and its anhydrate". Colloids and Surfaces B: Biointerfaces, volume 46, issue 3, pages 135–141. DOI:10.1016/j.colsurfb.2005.10.004
- ^ a b H. Benninga (1990): "A History of Lactic Acid Making: A Chapter in the History of Biotechnology". Volume 11 of Chemists and Chemistry. Springer, ISBN 9780792306252
- ^ Kook Hwa Choi, Yong Keun Chang, and Jin-Hyun Kim (2011) "Optimization of Precipitation Process for the Recovery of Lactic Acid". KSBB Journal, volume 26, pages 13-18. (Abstract Diarsipkan 2017-04-16 di Wayback Machine.)
- ^ a b "A gypsum-free, energy-saving route to lactic acid" Chemical Engineering, July 1, 2009.
- ^ Rojan P. John, K. Madhavan Nampoothiri, Ashok Pandey (2007): "Fermentative production of lactic acid from biomass: an overview on process developments and future perspectives" Applied Microbiology and Biotechnology, volume 74, issue 3, pages 524–534 DOI:10.1007/s00253-006-0779-6
- ^ a b c "Calcium Lactate Uses". www.tripurabiotech.com. Diarsipkan dari versi asli tanggal 2021-05-13. Diakses tanggal 2020-08-04.
- ^ Straub DA (June 2007). "Calcium supplementation in clinical practice: a review of forms, doses, and indications". Nutr Clin Pract. 22 (3): 286–96. doi:10.1177/0115426507022003286. PMID 17507729.
- ^ Sloan J. Wilson (1938): "Postoperative Parathyroid Insufficiency and Calcium Lactate". Archives of Surgery, volume 37, issue 3, pages 490-497. DOI:10.1001/archsurg.1938.01200030139008
- ^ A.B. Luckhardt and B. Goldberg (1923): "Preservation of the Life of Completely Parathyroidectomized Dogs by Means of the Oral Administration of Calcium Lactate." Journal of the American Medical Association, volume 80, issue 2, pages 79-80. DOI:10.1001/jama.1923.02640290009002
- ^ Carolyn A. Tylenda (2011): "Toxicological Profile for Fluorides, Hydrogen Fluoride, and Fluorine (Update)". DIANE Publishing. ISBN 9781437930771
- ^ U. S. Food and Drug Administration (2016): Code of Federal Regulations: Title 21 Volume 3, section 21CFR184.1207 "Calcium lactate" Diarsipkan 2017-04-15 di Wayback Machine., revised April 1, 2016
- ^ E.J. Pyler (1988), Baking Science and Technology, Sosland Publishing
- ^ Sudaa, R.; T. Suzukia; R. Takiguchib; K. Egawab; T. Sanob; K. Hasegawa (2006). "The Effect of Adding Calcium Lactate to Xylitol Chewing Gum on remineralization of Enamel Lesions". Caries Research. 40 (1): 43–46. doi:10.1159/000088905. PMID 16352880.
- ^ Luna-Guzman, Irene; Diane M. Barrett (2000). "Comparison of calcium chloride and calcium lactate effectiveness in maintaining shelf stability and quality of fresh-cut cantaloupes". Postharvest Biology and Technology. 19: 16–72. doi:10.1016/S0925-5214(00)00079-X.
- ^ B.N. Paul, S. Sarkar, S. S. Giri, S. N Mohanty, P. K. Mukhopadhyay (2006): "Dietary calcium and phosphorus requirements of rohu Labeo rohita fry". Animal Nutrition and Feed Technology, volume 6, issue 2, pages 257-263
- ^ R. Devesa-Rey, G. Bustos, J. M. Cruz, A. B. Moldes (2012): "Evaluation of Non-Conventional Coagulants to Remove Turbidity from Water". Water, Air, & Soil Pollution, volume 223, issue 2, pages 591–598. DOI:10.1007/s11270-011-0884-8
- ^ J.M. Irwan, L.H. Anneza, N. Othman, A. Faisal Alshalif (2016): "Compressive Strength and Water Penetration of Concrete with Enterococcus faecalis and Calcium Lactate". Key Engineering Materials, volume 705, pages 345-349. DOI:10.4028/www.scientific.net/KEM.705.345
- ^ Moneo, Shannon (11 September 2015). "Dutch scientist invents self-healing concrete with bacteria". Journal Of Commerce. Diarsipkan dari versi asli tanggal 22 March 2018. Diakses tanggal 21 March 2018.