Cloruro di molibdeno(II)
| Cloruro di molibdeno (II) | |
|---|---|
 | |
| Nome IUPAC | |
| Cloruro di molibdeno (II) | |
| Abbreviazioni | |
| Mocl2 | |
| Nomi alternativi | |
| Cloruro di molibdeno, Molibdeno (II) cloruro, Molibdeno (II) dicloruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | MoCl2 |
| Massa molecolare (u) | 166,84 |
| Aspetto | solido giallo |
| Numero CAS | |
| Numero EINECS | 236-774-3 |
| PubChem | 83514 e 22096571 |
| SMILES | [Cl-].[Cl-].[Mo+2] |
| Indicazioni di sicurezza | |
Col nome di cloruro di molibdeno(II) o dicloruro di molibdeno si intendono più composti chimici binari tra molibdeno e cloro con formula minima MoCl2. Si conoscono almeno due forme, che hanno attratto l'interesse dei ricercatori per la loro struttura inattesa e per il fatto che possono formare centinaia di derivati.
Struttura
[modifica | modifica wikitesto]Le specie di formula MoCl2 non adottano la struttura a impacchettamento compatto che ci si potrebbe aspettare, simile a quella presente in composti come rutilo e ioduro di cadmio. Il molibdeno(II) è un catione piuttosto grosso e preferisce formare composti con legami metallo-metallo, cioè composti cluster. Questo è il comportamento osservato anche per i metalli dei primi gruppi di transizione (gruppi del titanio, vanadio, cromo e manganese) nel formare alogenuri in stato di ossidazione minore di quattro (con rapporto alogenuro/metallo < 4).
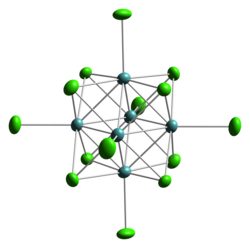
Una forma di MoCl2 ha in realtà formula Mo6Cl12, ed è un solido giallo, insolubile in acqua, che si decompone per riscaldamento oltre 530 °C. Si tratta di una specie polimerica formata da cluster cubici Mo6Cl84+ con altri leganti a ponte cloruro che connettono i vari cluster. Questo materiale si trasforma facilmente in sali contenenti il dianione [Mo6Cl14]2–. In questo anione i sei atomi di molibdeno formano un ottaedro contenuto in un cubo definito da otto atomi di cloro; l'intorno di coordinazione di ogni atomo di molibdeno consiste di quattro leganti cloruro a ponte triplo, quattro Mo vicini, più un atomo di cloro terminale. Il cluster possiede un numero "magico" di elettroni pari a 24; ogni Mo(II) ne fornisce quattro.
modello a sfere e bastoncini di parte di uno strato nella struttura cristallina di Mo6Cl12[1] |
modello a ellissoidi termici del cluster [Mo6Cl8]4+ |
modello a ellissoidi termici del cluster [Mo6Cl14]2−
|
Sintesi e reattività
[modifica | modifica wikitesto]Mo6Cl12 si prepara per reazione del cloruro di molibdeno(V) con molibdeno metallico:
- 12MoCl5 + 18Mo → 5Mo6Cl12
Questa reazione procede attraverso gli intermedi MoCl3 e MoCl4, anch'essi ridotti in presenza di un eccesso di molibdeno metallico. La reazione viene condotta in una fornace a tubo a 600–650 °C.[2]
Una volta isolato, Mo6Cl12 può dare molte reazioni mantenendo intatto il nucleo centrale Mo612+. Per riscaldamento in acido cloridrico concentrato forma (H3O)2[Mo6Cl14]. I cloruri terminali all'esterno possono essere scambiati facilmente:
- (H3O)2[Mo6Cl14] + 6HI → (H3O)2[Mo6Cl8I6] + 6HCl
In condizioni più drastiche si possono scambiare tutti e 14 i leganti, ottenendo sali contenenti gli anioni [Mo6Br14]2– e [Mo6I14]2–.
Cluster apparentati
[modifica | modifica wikitesto]Esistono vari cluster ci struttura simile a [Mo6Cl14]2–. L'analogo di tungsteno è noto. Tantalio e niobio formano cluster collegati dove gli alogenuri sono a ponte sugli spigoli dell'ottaedro anziché sulle facce; ne risulta la formula [Ta6Cl18]4–.
Sono molto studiati anche derivati di zolfo e selenio. [Re6Se8Cl6]4– ha lo stesso numero di elettroni esterni di [Mo6Cl12]2–.[3]
I cluster Mo6S8L6, analoghi delle "fasi di Chevrel", sono stati preparati per azione di fonti di solfuro con Mo6Cl14 in presenza di leganti donatori L.[4]
Note
[modifica | modifica wikitesto]- ^ H. G. von Schnering, W. May, K. Peters, Crystal structure of dodecachlorooctahedrohexamolybdenum, Mo6Cl12, in Z. Krist., vol. 208, n. 2, 1993, pp. 368–369, DOI:10.1524/zkri.1993.208.Part-2.368. URL consultato il 17 maggio 2011.
- ^ M. L. Larson, P. Nannelli, B. P. Block, Preparation of some metal halides anhydrous molybdenum halides and oxide halides—a summary: Molybdenum(ii) halides, in Inorg. Synth., vol. 12, 1970, pp. 170-178, DOI:10.1002/9780470132432.ch29. URL consultato il 19 maggio 2011.
- ^ S. C. Lee, R. H. Holm, Nonmolecular metal chalcogenide/halide solids and their molecular cluster analogues, in Angew. Chem. Int. Ed. Engl., vol. 29, n. 8, 1990, pp. 840-856, DOI:10.1002/anie.199008401. URL consultato il 19 maggio 2011.
- ^ T. Saito, Group 6 metal chalcogenide cluster complexes and their relationships to solid state cluster compounds, in Adv. Inorg. Chem., vol. 44, 1997, pp. 45-91.
Bibliografia
[modifica | modifica wikitesto]- N. N. Greenwood, A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- C. E. Housecroft, A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Cloruro di molibdeno(II)
Wikimedia Commons contiene immagini o altri file su Cloruro di molibdeno(II)