Deossizuccheri
 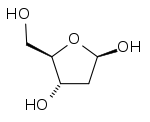
|
| Confronto tra la struttura chimica del ribosio (in alto) e del deossiribosio (in basso). |


I deossizuccheri sono glucidi in cui un gruppo ossidrilico è rimpiazzato da un atomo di idrogeno (deossigenazione). Sebbene la deossigenazione sia possibile in qualsiasi posizione all'interno della molecola glucidica, risultano maggiormente diffusi i 6-deossizuccheri.[1]
Il deossizucchero più abbondante in natura è il deossiribosio, 2-deossizucchero che interviene nella formazione dell'acido deossiribonucleico (DNA). Altri esempi di comuni deossizuccheri sono rappresentati dal D-chinovosio (6-deossi-D-glucopiranosio), L-ramnosio (6-deossi-L-mannopiranosio) e L-fucosio (6-deossi-L-galattopiranosio), tutti costituenti di molecole riscontrate tra l'altro in piante e batteri.
I dideossizuccheri, ovvero i glucidi in cui vengono rimpiazzati due gruppi OH, sono più rari ma non meno importanti. Si riscontrano come unità terminali di oligosaccaridi legati a proteine di superficie di vari batteri.
Sintesi e proprietà
[modifica | modifica wikitesto]I 3-, 4- e 6-deossizuccheri vengono generalmente sintetizzati per riduzione del carboidrato di partenza senza proteggere (mediante l'uso di un gruppo protettivo) il gruppo OH nella posizione che si intende deossigenare. I 2-deossizuccheri vengono convenientemente sintetizzati per idratazione con acetato mercurico dei glicali (zuccheri ciclici con un doppio legame in posizione 1,2) e successiva riduzione con sodio boroidruro.
La deossigenazione apporta delle modificazioni delle proprietà chimico-fisiche rispetto allo zucchero originario in cui è presente il gruppo OH. Ad esempio, nel caso del deossiribosio si ha la modificazione della stabilità dell'acido nucleico risultante, mentre la deossigenazione in posizione 6 produce un miglioramento delle interazioni idrofobiche con gli appropriati recettori di altre biomolecole.
Note
[modifica | modifica wikitesto]- ^ Stick, Williams, p.105
Bibliografia
[modifica | modifica wikitesto]- Robert V. Stick, Spencer J. Williams, Carbohydrates: The Essential Molecules of Life, Elsevier, 2009, ISBN 978-0-240-52118-3.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Deossizuccheri
Wikimedia Commons contiene immagini o altri file su Deossizuccheri
| Controllo di autorità | NDL (EN, JA) 00561485 |
|---|