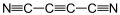Dicianoacetilene
| Dicianoacetilene | |
|---|---|
 | |
| Nome IUPAC | |
| But-2-inodinitrile | |
| Nomi alternativi | |
| Subnitruro di carbonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4N2 |
| Massa molecolare (u) | 76,06 g/mol |
| Aspetto | Liquido |
| Numero CAS | |
| PubChem | 14068 |
| SMILES | N#CC#CC#N |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,907 g/cm3 |
| Temperatura di fusione | 20,5 °C (68,9 °F; 293,6 K) |
| Temperatura di ebollizione | 76,5 °C (169,7 °F; 349,6 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | +500,4 kJ/mol |
| Indicazioni di sicurezza | |
Il dicianoacetilene, chiamato anche subnitruro di carbonio, è una sostanza chimica organica avente formula bruta C4N2 e formula di struttura N≡C-C≡C-C≡N. Come si vede da quest'ultima, il dicianoacetilene è una molecola lineare caratterizzata da un'alternanza di legami covalenti tripli e singoli; di fatto essa può essere vista come una molecola di acetilene con i due atomi di idrogeno sostituiti da due gruppi ciano.[1]
In condizioni standard il dicianoacetilene si presenta come un liquido chiaro e, a causa della sua elevata entalpia standard di formazione, esso può esplodere in polvere di carbonio e gas di azoto. Durante la combustione in ossigeno puro, il dicianoacetilene brucia con una splendente fiamma bianco-blu che arriva ad una temperatura di 5260 K (4990 °C, 9010 °F), che sale ad oltre 6000 K (5730 °C, 10340 °F) in ozono ad alta pressione.[2] Ciò fa di essa la fiamma più calda mai registrata in qualunque reazione chimica conosciuta. Il raggiungimento di una temperatura così elevata è in parte dovuto al fatto che, non essendo il dicianoacetilene un idrocarburo, non si ha presenza di idrogeno in quello che è il combustibile e quindi non si ha acqua tra i prodotti della combustione.
Sintesi
[modifica | modifica wikitesto]Il dicianoacetilene può essere ottenuto facendo fluire azoto gassoso su un campione di grafite scaldato ad una temperatura compresa tra i 2673 e i 3000 K.[3]
Utilizzo
[modifica | modifica wikitesto]Data la caratteristica di essere elettron-attrattori dei due gruppi ciano presenti, il dicianoacetilene è un potente dienofilo ed è quindi un utile reagente in quelle reazioni di Diels-Alder che coinvolgono dieni poco o per nulla reattivi. La sua natura di dienofilo molto reattivo fa sì che il dicianoacetilene sia anche utilizzato per attaccarsi a composti aromatici, ne è un esempio il suo uso con il durene (1,2,4,5-tetrametilbenzene), con il quale il dicianoacetilene forma un biciclooctatriene sostituito.[4]
Presenza in natura
[modifica | modifica wikitesto]Atmosfera di Titano
[modifica | modifica wikitesto]Grazie ad osservazioni effettuate con la spettroscopia infrarossa, è stato possibile rilevare la presenza di dicianoacetilene nell'atmosfera di Titano, il più grande dei satelliti naturali di Saturno.[5][6] Si pensa che il dicianoacetilene abbia qui avuto origine nell'alta atmosfera, come risultato di reazioni chimiche che avvengono tra le molecole di metano innescate dalla radiazione ultravioletta proveniente dal Sole.
Poiché durante il susseguirsi delle stagioni di Titano, il dicianoacetilene condensa ed evapora ciclicamente, la sua osservazione si è rivelata un ottimo strumento con cui i ricercatori sulla Terra possono studiare la meteorologia di Titano.
Mezzo interstellare
[modifica | modifica wikitesto]A causa della natura di molecola centrosimmetrica lineare del dicianoacetilene, per esso non si può osservare nessuno spettro a microonde e quindi non è stato possibile verificare la sua presenza nel mezzo interstellare. Tuttavia, poiché molecole simili al dicianoacetilene ma asimmetriche, ad esempio il cianoacetilene,[7] sono state osservate in nubi interstellari, la sua presenza in questi sistemi è ritenuta oggi fortemente probabile.[8]
Note
[modifica | modifica wikitesto]- ^ Shunsuke Murahashi, Takeo Takizawa, Shohei Kurioka e Seiji Maekawa, Cyanoacetylene. I. The synthesis and some chemical properties, in Nippon Kagaku Zasshi, vol. 77, n. 11, 1956, pp. 1689-1692, DOI:10.1246/nikkashi1948.77.1689.
- ^ (EN) A. D. Kirshenbaum e A. V. Grosse, THE COMBUSTION OF CARBON SUBNITRIDE, C 4 N 2 , AND A CHEMICAL METHOD FOR THE PRODUCTION OF CONTINUOUS TEMPERATURES IN THE RANGE OF 5000-6000°K. 1, in Journal of the American Chemical Society, vol. 78, n. 9, 1956-05, pp. 2020–2020, DOI:10.1021/ja01590a075. URL consultato il 21 marzo 2023.
- ^ E. Ciganek e C. G. Krespan, Syntheses of Dicyanoacetylene, in The Journal of Organic Chemistry, vol. 33, n. 2, 1968, pp. 541-544, DOI:10.1021/jo01266a014.
- ^ C. D. Weis, Reactions of Dicyanoacetylene, in Journal of Organic Chemistry, vol. 28, n. 1, 1963, pp. 74-78, DOI:10.1021/jo01036a015.
- ^ H. B. Niemann et al., The abundances of constituents of Titan's atmosphere from the GCMS instrument on the Huygens probe, in Nature, vol. 438, n. 7069, 2005, pp. 779-784, Bibcode:2005Natur.438..779N, DOI:10.1038/nature04122, PMID 16319830.
- ^ R. E. Samuelson, L. A. Mayo, M. A. Knuckles e R. J. Khanna, C4N2 Ice in Titan's North Polar Stratosphere, in Planetary and Space Science, vol. 45, n. 8, 1997, pp. 941-948, Bibcode:1997P&SS...45..941S, DOI:10.1016/S0032-0633(97)00088-3.
- ^ Philip M. Solomon, Interstellar molecules, in Physics Today, vol. 26, n. 3, 1973, pp. 32-40, Bibcode:1973PhT....26c..32S, DOI:10.1063/1.3127983.
- ^ R. Kołos, Exotic Isomers of Dicyanoacetylene: A Density Functional Theory and ab initio Study, in Journal of Chemical Physics, vol. 117, n. 5, 2002, pp. 2063-2067, Bibcode:2002JChPh.117.2063K, DOI:10.1063/1.1489992.
Voci correlate
[modifica | modifica wikitesto]- Molecole del mezzo interstellare
- Acido cianidrico, H-C≡N
- Cianoacetilene, H-C≡C-C≡N
- Cianogeno, N≡C-C≡N
- Diacetilene, H-C≡C-C≡C-H
- Poliini, R-(-C≡C-)n-R
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Dicianoacetilene
Wikimedia Commons contiene immagini o altri file su Dicianoacetilene