Elettrosintesi
L'elettrosintesi rappresenta una metodica di sintesi organica attuata in una cella elettrochimica. I vantaggi principali di una reazione elettrosintetica, rispetto alla classica reazione redox, consiste nell'assenza di semireazioni potenzialmente nocive al processo globale e nella possibilità di operare a precisi valori di potenziale predeterminati.
L'elettrosintesi rappresenta un ampio campo di studio, con molte applicazioni industriali.
Condizioni operative
[modifica | modifica wikitesto]Gli elementi strumentali fondamentali per una elletrosintesi sono una cella galvanica, un potenziometro e due elettrodi. Il solvente utilizzato è solitamente il metanolo, l'acetonitrile o il diclorometano. Viene addizionato anche un elettrolita, solitamente il perclorato di litio o l'acetato di tetrabutilammonio. L'elettrodo può essere costituito da platino, carbonio, magnesio, mercurio, acciaio inossidabile o carbonio amorfo reticolato. In molte reazioni si usa un elettrodo sacrificale in zinco o piombo che viene consumato durante la reazione.
L'elettrosintesi può essere condotta a potenziale costante o a corrente costante.
Reazioni elettrosintetiche
[modifica | modifica wikitesto]All'anodo avvengono ossidazioni con formazione iniziale di cationi radicalici che agiscono come reattivi intermedi. Al catodo si ottengono composti ridotti ad anioni radicalici. La reazione iniziale avviene sulla superficie dell'elettrodo e successivamente gli intermedi reattivi diffondono in soluzione per partecipare a reazioni secondarie.
Ossidazioni anioniche
[modifica | modifica wikitesto]- L'elettrosintesi più nota è l'elettrolisi di Kolbe.
- Una variante, quando un eteroatomo di azoto o ossigeno è presente in posizione α. L'intermedio carbocationico lega un nucleofilo, solitamente il solvente utilizzato.
- Nella reazione di Crum Brown-Walker un acido bicarbossilico alifatico viene ossidato con allungamento della catena, per esempio si consideri la formazione dell'estere dimetilico dell'acido decandioico dall'acido monometil-esandioico.
- Le ammidi possono essere ossidate attraverso un intermedio N-acilimminio, che può reagire con un nucleofilo:

- Questo tipo di reazione è chiamata ossidazione di Shono. Un esempio è rappresentato dalla α-metossilazione della N-carbometossipirrolidina.
- L'ossidazione di un carbanione può portare ad una reazione di accoppiamento, ciò che avviene, per esempio, nell'elettrosintesi dell'estere tetrametilico dell'acido etantetraoico dal corrispondente estere malonico.
Riduzioni cationiche
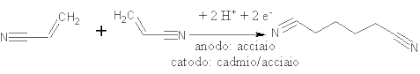
[modifica | modifica wikitesto]- L'idrodimerizzazione catodica di olefine attivate è industrialmente applicata nella sintesi dell'adiponitrile da due molecole di acrilonitrile:
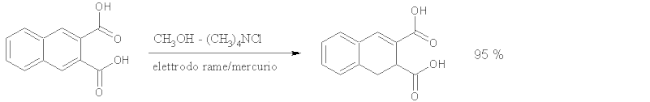
- La riduzione catodica degli areni a 1,4-diidro derivati è simile alla riduzione con sodio metallico in ammoniaca liquida. Un esempio di applicazione industriale è dato dalla riduzione dell'acido orto-ftalico:
e dalla riduzione del 2-metossinaftalene
Bibliografia
[modifica | modifica wikitesto]- The application of cathodic reductions and anodic oxidations in the synthesis of complex molecules Jeffrey B. Sperry and Dennis L. Wright Chem. Soc. Rev., 2006, 35, 605 - 621
- Topics in current chemistry. Electrochemistry, Vol. 3 (Topics in Current Chemistry, Vol. 148) E. Steckhan (Ed), Springer, NY 1988
| Controllo di autorità | GND (DE) 4151767-2 |
|---|