Ossitricloruro di vanadio
| Ossitricloruro di vanadio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Ossitricloruro di vanadio | |
| Nomi alternativi | |
| Tricloruro di vanadile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | VOCl3 |
| Massa molecolare (u) | 173,30 |
| Aspetto | liquido giallo |
| Numero CAS | |
| Numero EINECS | 231-780-2 |
| PubChem | 24410 |
| SMILES | Cl[V](Cl)(Cl)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,826 |
| Indice di rifrazione | 1,630 |
| Solubilità in acqua | decomposizione violenta |
| Temperatura di fusione | −77 °C (196 K)[1] |
| Temperatura di ebollizione | 127 °C (400 K)[1] |
| Tensione di vapore (Pa) a 293 K | 810[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –741[2] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 140 oral rat[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 301 - 314 [1] |
| Consigli P | 280 - 301+310 - 305+351+338 - 310 [1] |
L'ossitricloruro di vanadio o tricloruro di vanadile[3] è il composto inorganico del vanadio pentavalente di formula VOCl3,[2] contenente il vanadile VO,[4] un gruppo piuttosto comune nella chimica del vanadio.[5]
In condizioni normali è un liquido giallo chiaro, non infiammabile e distillabile.[6][7] Per alcuni aspetti del suo comportamento chimico è simile al tricloruro di fosforile POCl3, ad esso isoelettronico di valenza, ma ne differisce per essere decisamente ossidante, come gli altri composti di vanadio(V).[8]
Struttura molecolare e proprietà
[modifica | modifica wikitesto]Il tricloruro di vanadile è igroscopico e a contatto con l'umidità dell'aria si idrolizza rapidamente, come pure fa vigorosamente con l'acqua o, meno velocemente, con alcoli e solventi protici in genere.[9][10] È solubile in solventi organici aprotici polari come l'acetone (μ = 2,91 D), il diclorometano (μ = 1,62 D), l'etere etilico (1,15 D) e aprotici non polari, come esano, benzene e tetracloruro di carbonio (μ = 0).[11] Viene usato come reattivo in sintesi organica.[12]
Il tricloruro di vanadile è un composto termodinamicamente molto stabile, ΔHƒ° = -701,76 ± 1,30 kJ/mol,[13] ma è anche un forte ossidante: in ambiente acido il suo potenziale standard di riduzione è E° = 1,0 V, cioè appena meno di quello del bromo (1,07 V).[14] Parallelamente, la capacità della molecola di catturare elettroni è testimoniata anche dalla sua affinità elettronica, riportata come > (3,60 ± 0,50) eV;[15] per confronto, quella di POCl3 è (1,41 ± 0,20) eV.[16]
Configurazione elettronica e struttura molecolare
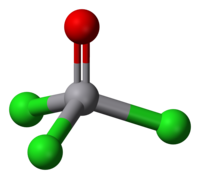
[modifica | modifica wikitesto]Il vanadio in questo composto ha il suo massimo stato di ossidazione, +5, al quale corrisponde la configurazione elettronica 3 d 0, il che comporta che non ci sono elettroni spaiati e il composto è quindi diamagnetico.[10] La forma della molecola è un tetraedro quasi regolare, con simmetria molecolare C3v;[17] dato che i legami con i clori e e quello con l'ossigeno puntano da parti opposte, i loro momenti di dipolo tendono a sottrarsi vettorialmente e il momento dipolare complessivo della molecola risulta basso: in soluzione di CCl4 a 25 °C è riportato come μ = 0,3 D.[18]
VOCl3 è un composto molecolare sia in fase vapore che allo stato solido cristallino.[19]
Da un'indagine diffrattometrica ai raggi X su un monocristallo di VOCl3 risulta che la molecola nel reticolo cristallino ha simmetria Cs, minore di quella in fase gassosa (C3v). Il legame V=O è lungo 156,2 pm e i legami V–Cl 212,4 pm (medio); l'angolo medio O-V-Cl è di 107,2° e quello medio Cl-V-Cl è di 111,9°.[19]
Da un'indagine di diffrazione elettronica in fase gassosa si trovano valori molto simili; il legame V=O risulta essere lungo 157,1 pm, quello V–Cl 213,7 pm; l'angolo O-V-Cl è di 107,8° e quello Cl-V-Cl è di 111,0°.[20][21]
Sintesi
[modifica | modifica wikitesto]VOCl3 può essere sintetizzato in vari modi. Una procedura prevede la clorurazione di V2O5 mescolato a carbone e scaldato al calor rosso.[22] Questa stessa reazione si può effettuare anche partendo da V2O3.[23] Il carbone serve per catturare l'ossigeno, dando monossido di carbonio, in modo analogo a quanto succede nel processo Kroll per la sintesi di TiCl4:
- V2O5 + 3 Cl2 + 3 C → 2 VOCl3 + 3 CO
- V2O3 + 3 Cl2 + C → 2 VOCl3 + CO
Alternativamente, si riscalda con cautela fino a circa 400 °C una miscela di V2O5 e AlCl3 anidro; l'allumina formata è involatile, mentre il VOCl3 viene separato per distillazione:[24]
- V2O5 + 2 AlCl3 → 2 VOCl3 + Al2O3
La clorurazione si può effettuare anche con SOCl2:[23]
- V2O5 + 3 SOCl2 → 2 VOCl3 + 3 SO2
Reattività
[modifica | modifica wikitesto]
Il tricloruro di vanadile è un composto stabile fino a circa 180 °C, solubile in etere etilico e acido acetico glaciale, in alcool etilico ed altri alcoli si scioglie ma reagisce (vide infra).[23] Risulta molto sensibile all'umidità. In presenza di quantità anche minime di acqua si idrolizza rapidamente formando anidride vanadica (pentossido di divanadio, rosso-arancio), che si idrata pochissimo, e acido cloridrico:[24]
- 2 VOCl3 + 3 H2O → V2O5 + 6 HCl
Questa reazione è molto simile a quella di POCl3 e l'unica differenza è che la corrispondente anidride fosforica, diversamente dalla vanadica, è avidissima di acqua e si idrata immediatamente dando acido forforico.
In presenza di alcoli la reazione è dello stesso tipo (alcoolisi, invece di idrolisi) e si formano alcossidi di vanadile, ossia ortovanadati alchilici, cioè esteri dell'acido ortovanadico[25] (molto poco stabile, H3VO4), che è analogo ad H3PO4:
- VOCl3 + 3 ROH → VO(OR)3 + 3 HCl
Il tricloruro di vanadile si usa nella sintesi del dicloruro di vanadile (VOCl2, VIV) in una reazione di comproporzione:[26]
- V2O5 + VOCl3 + 3 VCl3 → 6 VOCl2
Nella reazione con l'anidride ipoclorosa viene trasformato in cloruro di diossovanadio (VO2Cl) e il cloro presente viene in parte ossidato a Cl2:[27]
- VOCl3 + Cl2O → VO2Cl + 2 Cl2
VOCl3 è un acido di Lewis e forma addotti con basi di Lewis come acetonitrile e ammine. Nella formazione dell'addotto la coordinazione del vanadio diventa ottaedrica.[2] Un esempio è la reazione con trietilammina:
- VOCl3 + 2 NEt3 → VOCl3(NEt3)2
Con gli ammino N-ossidi si formano similmente complessi ottaedrici; ad esempio, con la piridina N-ossido (PyNO):[28]
- VOCl3 + 2 PyNO → VOCl3(PyNO)2
Con diammine può raggiungere la coordinazione ottaedrica anche formando addotti 1:1, con formazione di un anello; nel caso della o-fenantrolina (Phen), un anello a cinque termini:[28]
- VOCl3 + Phen → VOCl3(Phen)
Con anioni come specie donatrici il tricloruro di vanadile forma complessi stabili; con lo ione cloruro si ottengono sali dello ione complesso ossotetraclorovanadato(V), [O=VCl4] –, dove l'atomo di vanadio adotta una coordinazione piramidale a base quadrata, con l'atomo di ossigeno sul vertice;[29] ad esempio, con cloruri di ammonio quaternario, si ha:[30]
- Et4N+Cl – + VOCl3 → [Et4N+] [VOCl4] –
Come acido di Lewis, Il tricloruro di vanadile riesce anche a strappare uno ione cloruro dal pentacloruro di fosforo, formando il corrispondente sale di tetraclorofosfonio PCl4+:[29]
- PCl5 + VOCl3 → [Cl4P]+ [VOCl4] –
Usi
[modifica | modifica wikitesto]VOCl3 è usato come catalizzatore nella produzione di gomme etilene-propilene (EPDM) e come materiale di partenza per la sintesi di composti organici di vanadio.[31]
Tossicità / Indicazioni di sicurezza
[modifica | modifica wikitesto]VOCl3 è disponibile in commercio. Il composto è tossico per ingestione e inalazione. Risulta corrosivo per tutte le mucose, gli occhi e la cute. A contatto con acqua reagisce violentemente sviluppando acido cloridrico.[1]
Note
[modifica | modifica wikitesto]- ^ a b c d e f g GESTIS, GESTIS.
- ^ a b c Holleman e Wiberg 2007
- ^ CRC Handbook of Chemistry and Physics, 97ª ed., CRC Press, 31 luglio 2016, DOI:10.1201/9781315380476, ISBN 978-1-315-38047-6. URL consultato il 15 luglio 2023.
- ^ Di questo gruppo esistono composti di VIII (VOCl), VIV (VOCl2) e VV (VOF3).
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 995, ISBN 0-7506-3365-4.
- ^ Greenwood e Earnshaw 1997
- ^ Richards 2006
- ^ (EN) Vanadium_oxytrichloride, su chemeurope.com. URL consultato il 15 luglio 2023.
- ^ gestis.dguv.de, https://gestis.dguv.de/data?name=005140. URL consultato il 1º dicembre 2024.
- ^ a b (EN) Vanadium_oxytrichloride, su www.chemeurope.com. URL consultato il 1º dicembre 2024.
- ^ VANADIUM(V) TRICHLORIDE OXIDE CAS#: 7727-18-6, su chemicalbook.com. URL consultato il 15 luglio 2023.
- ^ O'Brien e Vanasse 2001
- ^ (EN) N. G. Dmitrieva, P. A. Romodanovskii e S. N. Gridchin, The enthalpies of solution of VOCl3 in dilute solutions of sodium hydroxide and the standard enthalpy of formation of liquid VOCl3, in Russian Journal of Physical Chemistry A, vol. 84, n. 1, 2010-01, pp. 143–145, DOI:10.1134/S0036024410010280. URL consultato il 15 luglio 2023.
- ^ Advanced inorganic chemistry, 6th ed, J. Wiley, 1999, ISBN 978-0-471-19957-1.
- ^ vanadium trichloride oxide, su webbook.nist.gov.
- ^ Phosphorus oxychloride, su webbook.nist.gov.
- ^ CHAPTER 4: SYMMETRY AND GROUP THEORY (PDF), su University of California, Irvine.
- ^ (EN) Charles N. Caughlan e Fred Cartan, Electric Moments of VCl 4 and VOCl 3, in Journal of the American Chemical Society, vol. 81, n. 15, 1959-08, pp. 3840–3841, DOI:10.1021/ja01524a010. URL consultato il 15 luglio 2023.
- ^ a b (EN) Jean Galy, Renée Enjalbert e Gérard Jugie, VOCl3: Crystallization, crystal structure, and structural relationships: A joint X-ray and 35Cl-NQR investigation, in Journal of Solid State Chemistry, vol. 47, n. 2, 1983-04, pp. 143–150, DOI:10.1016/0022-4596(83)90003-8. URL consultato il 15 luglio 2023.
- ^ (DE) H. Oberhammer e J. Strähle, Die Molekülstruktur des Vanadium-(N-chlorimid)-trichlorids, Cl3V=NCl, und des Vanadiumoxidtrichlorids, Cl3V=O, in der Gasphase, in Zeitschrift für Naturforschung A, 30a, 1975, pp. 296-303.
- ^ A. F. Holleman, E. Wiberg e N. Wiberg, XXVI. Die Vanadiumgruppe, in Anorganische Chemie, vol. 2, 103ª ed., De Gruyter, 2016, pp. 1822-1823, ISBN 978-3-11-026932-1.
- ^ Woolery 1998
- ^ a b c Brauer 1965
- ^ a b Johannesen 1960
- ^ (EN) PubChem, Vanadic acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 15 luglio 2023.
- ^ G. Brauer, Vanadium Oxydichloride, in G. Brauer (a cura di), Handbook of Preparative Inorganic Chemistry, 2nd Ed., NY, Academic Press, 1963, pp. 1263.
- ^ (DE) H. Oppermann, Untersuchungen an Vanadinoxidchloriden und Vanadinchloriden. I. Gleichgewichte mit VOCl3, VO2Cl und VOCl2, in Zeitschrift f�r anorganische und allgemeine Chemie, vol. 351, n. 3-4, 1967-05, pp. 113–126, DOI:10.1002/zaac.19673510302. URL consultato il 15 luglio 2023.
- ^ a b (EN) Charlotte D. Beard, Rosalind J. Barrie e John Evans, Synthesis and Properties of Complexes of Vanadium(V) Oxide Trichloride with Nitrogen‐ and Oxygen‐Donor Ligands, in European Journal of Inorganic Chemistry, vol. 2006, n. 21, 2006-11, pp. 4391–4398, DOI:10.1002/ejic.200600513. URL consultato il 15 luglio 2023.
- ^ a b M. L. Roldán, H. Lanús e S. H. Brandán, The infrared and raman spectra of tetrachlorophosphonium (V) oxotetrachlorovanadate (V), PCL4VOCL4. An experimental and theoretical study, in The Journal o/ the Argentine Chemical Society, vol. 92, n. 1/3, 2004, pp. 53-61.
- ^ (EN) D. Nicholls e D. N. Wilkinson, Preparation and properties of oxotetrachlorovanadates(V), in Journal of the Chemical Society A: Inorganic, Physical, Theoretical, 1970, pp. 1103, DOI:10.1039/j19700001103. URL consultato il 15 luglio 2023.
- ^ Bauer et al. 2002
Bibliografia
[modifica | modifica wikitesto]- (EN) G. Bauer, V. Güther, H. Hess e altri, Vanadium and Vanadium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a27_367.
- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 2, 2ª ed., New York, Academic Press, 1965.
- GESTIS, Vandanyl trichloride, su gestis-en.itrust.de. URL consultato il 12 dicembre 2015 (archiviato dall'url originale il 22 dicembre 2015).
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) R. B. Johannesen, Vanadium Oxytrichloride, in Inorg. Synth., vol. 6, 1960, pp. 119-120, DOI:10.1002/9780470132371.ch38.
- (EN) M. K. O'Brien e B. Vanasse, Vanadyl Trichloride, in e-EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001, DOI:10.1002/047084289X.rv004.
- (EN) R. Richards, Vanadium: Inorganic & Coordination Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia253, ISBN 9780470862100.
- (EN) M. Woolery, Vanadium Compounds, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Ossitricloruro di vanadio
Wikimedia Commons contiene immagini o altri file su Ossitricloruro di vanadio