Pirene
| Pirene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| pirene | |
| Nomi alternativi | |
| benzo[def]fenantrene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C16H10 |
| Massa molecolare (u) | 202,255 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| Numero EINECS | 204-927-3 |
| PubChem | 31423 |
| SMILES | C1=CC2=C3C(=C1)C=CC4=CC=CC(=C43)C=C2 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,271 |
| Indice di rifrazione | 1,8520 (stima) |
| Solubilità in acqua | 0,146 mg/L (a 25 °C) |
| Coefficiente di ripartizione 1-ottanolo/acqua | 5,08 |
| Temperatura di fusione | 156 °C (429,15 K)[1] |
| Temperatura di ebollizione | 393,5 °C (666,65 K)[1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 473÷493[1] |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 410 |
| Consigli P | 273 - 501 [2][3] |
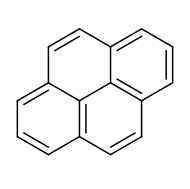
Il pirene è un idrocarburo tetraciclico benzenoide[4] avente formula C16H10 e costituito da 4 anelli benzenici condensati che condividono con gli altri anelli due o tre lati del proprio anello, e non uno solo, come accade nella serie degli aceni (come nell'antracene) o in quella dei fenaceni[5] (come nel fenantrene), cosa che si riscontra anche nel suo nome sistematico di benzo[def]fenantrene.[6]
Il pirene è un isomero strutturale del fluorantene, idrocarburo tetraciclico aromatico non benzenoide, del quale è più stabile.
La molecola, classificata tra quelle degli idrocarburi policiclici aromatici (IPA), è planare, altamente simmetrica (gruppo puntuale D2h),[7] con tutti gli atomi di carbonio ibridati sp2.
Etimologia
[modifica | modifica wikitesto]Il termine «pirene» compare nell'Ottocento in alcuni scritti di J. Hull, medico e botanico.[8] È formato dal nome greco del fuoco, pyr (πῦρ),[9] seguìto dalla desinenza -ene che designa l'insaturazione in alcheni e areni.[10] Il senso è che il pirene, un arene contenuto nella frazione più pesante del catrame di carbon fossile necessita, per il suo ottenimento, che la temperatura della distillazione sia adeguatamente elevata.[11] Il termine è presente in lingua italiana dal 1871.[12]
Struttura molecolare e aromaticità
[modifica | modifica wikitesto]Nell'ambito della teoria del legame di valenza, alla stabilità della molecola del pirene concorrono sei forme di risonanza, tutte strutture di Kekulé.[13] Sebbene sia annoverato tra gli idrocarburi aromatici, la sua molecola contiene un totale di 16 elettroni π (4n elettroni, con n = 4), rientrando così, formalmente, tra gli idrocarburi antiaromatici secondo la regola di Hückel, la quale però è strettamente valida solo per composi monociclici (vide infra).[14]
Sottostruttura del [14]annulene
[modifica | modifica wikitesto]Tuttavia, il pirene può essere considerato come derivante dalla sottostruttura di un [14]annulene. Questo è previsto essere aromatico con n = 3, ma non è benzenoide e in realtà risulta solo debolmente aromatico e non molto stabile.[15][16] In tal senso, all'interno di un [14]annulene si può immaginare un «doppio legame» >C=C< connesso all'anello che lo circonda tramite «legami semplici» ai carboni 3a, 5a, 8a, 10a. A tal proposito, si trova che il suo derivato 15,16-trans-dimetildiidropirene, nel quale quel doppio legame è diventato singolo, risulta essere aromatico,[17][18] come mostra lo spostamento chimico a valori negativi dei due metili negli spettri di risonanza magnetica protonica.[19]
Sottostruttura del bifenile
[modifica | modifica wikitesto]Oppure, il pirene può essere considerato come un bifenile,[20] anch'esso aromatico, benzenoide e molto stabile, al quale si aggiungono due ponti vinilene (−CH=CH−)[21] che si collegano esternamente, con legami singoli, alle posizioni 3a e 5a, l'uno e le 8a e10a, l'altro. Quest'ultima ipotesi è avvalorata, da un punto di vista teorico, dalla regola di Clar[22][23] dei sestetti aromatici benzenoidi[24] e, dal punto di vista sperimentale, dai risultati di reazioni di parziale idrogenazione e parziale ozonolisi.
Idrogenazione
[modifica | modifica wikitesto]In esperimenti di idrogenazione catalitica del pirene i prodotti significativi sono quelli che derivano dalla rimozione dei due «doppi legami» C4=C5 e C9=C10, cioè quelli dei ponti vinilene, lasciando così la struttura del bifenile (altri prodotti lasciano tuttavia la struttura del naftalene).[25]
Ozonolisi
[modifica | modifica wikitesto]Sono stati condotti esperimenti di ozonolisi del pirene in soluzione di acetonitrile/acqua 90/10. L'ozono è un ossidante potente (E° = 2,075 V[26]) e pertanto in genere si osservano miscele di vari prodotti; tuttavia, partendo da un rapporto ozono/pirene basso e incrementando l'ozono in esperimenti successivi si registrano andamenti caratteristici: dapprima si osservano principalmente prodotti derivanti dalla rottura di uno dei doppi legami (C4=C5), cosa che lascia lo scheletro aromatico del fenantrene (che è equivalente anch'esso a un bifenile con un ponte vinilene, secondo la regola di Clar[23]) e, a rapporti maggiori, si osserva la prevalenza di prodotti in cui anche il secondo doppio legame (C9=C10) risulta rotto, lasciando lo scheletro del bifenile.[27]
Dati strutturali e confronti
[modifica | modifica wikitesto]Dalla struttura cristallina del pirene (diffrazione dei raggi X) risulta che la molecola è essenzialmente planare e che questi due doppi legami (C4=C5 e C9=C10) sono pari a 132,0 pm e sono in effetti i più corti nella molecola,[13] anche lievemente più corti che nell'etilene (133,9 pm).[28] Parallelamente, i legami piu lunghi sono d e f, e gli altri due equivalenti (k e m) dall'atra parte (144,2 pm), cioè proprio quelli che sarebbero singoli considerando la sottostruttura del bifenile raccordata dai ponti vinilene. Per il resto, gli altri legami variano entro limiti che sono ragionevolmente normali per gli idrocarburi policiclici aromatici (138,0-142,0 pm).[13]
Aromaticità complessiva
[modifica | modifica wikitesto]Nonostante il pirene sia un sistema di 4n elettroni π, il suo carattere è stato riconosciuto essere nel suo complesso aromatico attraverso calcoli quantomeccanici teorici[29] e attraverso la valutazione della sua energia di stabilizzazione tramite valutazione energetica di reazioni isodesmiche[30] e valutazione della sua stabilizzazione per risonanza nell'ambito della teoria del legame di valenza.[31]
Proprietà
[modifica | modifica wikitesto]Il pirene, come gli altri idrocarburi policiclici aromatici,[32] è un composto endotermico: ΔHƒ° = +125,2 ± 2,3 kJ/mol,[33] ma meno endotermico (più stabile) dell'isomero fuorantene, ΔHƒ° = +190,2 ± 2,8 kJ/mol.[34]
A temperatura ambiente il pirene è un solido cristallino incolore pressoché insolubile in acqua (0,013 mg/100 g),[35] ma facilmente solubile in alcool, etere, benzene, toluene, solfuro di carbonio e tuttavia molto poco solubile in tetracloruro di carbonio.[36] Il pirene mostra intense bande di assorbimento nella regione del vicino ultravioletto (≈ 330 nm) e, sia come solido che nelle sue soluzioni, mostra leggera fluorescenza azzurra.[37][38]
Presenza in natura e nell'ambiente
[modifica | modifica wikitesto]In natura è contenuto nell'olio di catrame di carbon fossile; è presente, insieme ad altri composti policiclici aromatici, anche nel mezzo interstellare.[39] si forma durante la combustione incompleta dei composti organici, compreso il legno, come negli incendi boschivi.[40] Il pirene si trova contenuto anche negli scarichi delle automobili, che ne producono ≈ 1μg/km.[41]
Viene utilizzato nella produzione di coloranti e loro precursori (ad esempio la piranina).
È un composto tossico per i reni e per il fegato.

Note
[modifica | modifica wikitesto]- ^ a b c Copia archiviata, su biade.itrust.de. URL consultato il 13 agosto 2011 (archiviato dall'url originale il 13 agosto 2011).
- ^ Sigma Aldrich; rev. del 19.09.2012
- ^ Smaltire presso un impianto di trattamento dei rifiuti autorizzato
- ^ (EN) Ivan Gutman e Sven Josef Cyvin, Benzenoid Hydrocarbons, Springer Berlin Heidelberg, 1989, pp. 1–10, DOI:10.1007/978-3-642-87143-6_1, ISBN 978-3-642-87145-0. URL consultato il 26 settembre 2024.
- ^ (EN) Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 8ª ed., 2020, pp. 84-85, ISBN 9781119371786.
- ^ pyrene (CHEBI:39106), su ebi.ac.uk. URL consultato il 4 settembre 2024.
- ^ CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 16 luglio 2022.
- ^ pyrene, su Oxford English Dictionary.
- ^ (EN) Olivetti Media Communication-Enrico Olivetti, DIZIONARIO GRECO ANTICO - Greco antico - Italiano, su grecoantico.com. URL consultato il 2 ottobre 2024.
- ^ -ene > significato - Dizionario italiano De Mauro, su Internazionale. URL consultato il 14 ottobre 2024.
- ^ Pirène - Significato ed etimologia - Vocabolario, su Treccani. URL consultato l'11 novembre 2024.
- ^ Pirene > significato - Dizionario italiano De Mauro, su Internazionale. URL consultato l'11 novembre 2024.
- ^ a b c A. Camerman e J. Trotter, The crystal and molecular structure of pyrene, in Acta Crystallographica, vol. 18, n. 4, 1º aprile 1965, pp. 636–643, DOI:10.1107/S0365110X65001494. URL consultato il 4 settembre 2024.
- ^ (EN) John D. Roberts, Andrew Streitwieser e Clare M. Regan, Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals 1, in Journal of the American Chemical Society, vol. 74, n. 18, 1952-09, pp. 4579–4582, DOI:10.1021/ja01138a038. URL consultato il 16 luglio 2022.
- ^ (EN) Chian C. Chiang e Iain C. Paul, Crystal and molecular structure of [14]annulene, in Journal of the American Chemical Society, vol. 94, n. 13, 1972-06, pp. 4741–4743, DOI:10.1021/ja00768a058. URL consultato l'11 novembre 2024.
- ^ (EN) Franz Sondheimer e Yehiel Gaoni, UNSATURATED MACROCYCLIC COMPOUNDS. XV. 1 CYCLOTETRADECAHEPTAENE, in Journal of the American Chemical Society, vol. 82, n. 21, 1960-11, pp. 5765–5766, DOI:10.1021/ja01506a061. URL consultato l'11 novembre 2024.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 273-274.
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, pp. 80-81, ISBN 978-1-119-37179-3.
- ^ Ralph J. Fessenden e Joan S. Fessenden, ORGANIC CHEMISTRY, 2ª ed., PWS Publishers, 1982, p. 367, ISBN 0-87150-752-8.
- ^ (EN) Benedikt P. Klein, Lukas Ruppenthal e Samuel J. Hall, Topology Effects in Molecular Organic Electronic Materials: Pyrene and Azupyrene**, in ChemPhysChem, vol. 22, n. 11, 4 giugno 2021, pp. 1065–1073, DOI:10.1002/cphc.202100222. URL consultato il 14 ottobre 2024.«The conjugated system of pyrene is best described as a biphenyl with two ethenediyl bridges»
- ^ The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - heteroarenes (H02791), su goldbook.iupac.org. URL consultato il 13 ottobre 2024.«vinylene (–CH=CH–) groups»
- ^ Eric Clar, The Aromatic Sextet, Springer Netherlands, 1983, pp. 49–58, DOI:10.1007/978-94-009-7197-4_4, ISBN 978-94-009-7199-8. URL consultato il 15 luglio 2022.
- ^ a b Miquel Solà, Forty years of Clar's aromatic π-sextet rule, in Frontiers in Chemistry, vol. 1, 2013, DOI:10.3389/fchem.2013.00022. URL consultato il 15 luglio 2022.
- ^ (EN) Erich Kleinpeter e Andreas Koch, Identification of Benzenoid and Quinonoid Structures by Through-Space NMR Shieldings (TSNMRS), in The Journal of Physical Chemistry A, vol. 114, n. 18, 13 maggio 2010, pp. 5928–5931, DOI:10.1021/jp101429n. URL consultato il 15 luglio 2022.
- ^ Masahiro Minabe e Katsuko Nakada, Hydrogenation of Pyrene and Catalytic Interconversion of Hydropyrenes, in Bulletin of the Chemical Society of Japan, vol. 58, n. 7, 1º luglio 1985, pp. 1962–1966, DOI:10.1246/bcsj.58.1962. URL consultato il 15 luglio 2022.
- ^ Standard potentials in aqueous solution, collana Monographs in electroanalytical chemistry and electrochemistry, Dekker, 1985, ISBN 978-0-8247-7291-8. URL consultato l'11 novembre 2024.
- ^ Jehng-Jyun Yao, Zhi-Heng Huang e Susan J. Masten, The ozonation of pyrene: Pathway and product identification, in Water Research, vol. 32, n. 10, 1º ottobre 1998, pp. 3001–3012, DOI:10.1016/S0043-1354(98)00056-6. URL consultato l'11 novembre 2024.
- ^ Experimental data for C2H4 (Ethylene), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ J.I. Wu, M.A. Dobrowolski e M.K. Cyrański, On the aromatic stabilization energy of the 4N π electron pyrene, in Molecular Physics, vol. 107, n. 8-12, 20 aprile 2009, pp. 1177–1186, DOI:10.1080/00268970902784918. URL consultato il 16 luglio 2022.
- ^ (EN) J.I. Wu, M.A. Dobrowolski e M.K. Cyrański, On the aromatic stabilization energy of the 4N π electron pyrene, in Molecular Physics, vol. 107, n. 8-12, 20 aprile 2009, pp. 1177–1186, DOI:10.1080/00268970902784918. URL consultato il 14 ottobre 2024.
- ^ (EN) Remco W. A. Havenith, Joop H. van Lenthe e Fokke Dijkstra, Aromaticity of Pyrene and Its Cyclopentafused CongenersResonance and NICS Criteria. An Ab Initio Valence Bond Analysis in Terms of Kekulé Resonance Structures, in The Journal of Physical Chemistry A, vol. 105, n. 15, 1º aprile 2001, pp. 3838–3845, DOI:10.1021/jp003344k. URL consultato il 16 luglio 2022.
- ^ Francis A. Carey e Richard J. Sundberg, Advanced organic chemistry, 5th ed, Springer, 2007, p. 268, ISBN 978-0-387-44897-8.
- ^ Pyrene, su webbook.nist.gov.
- ^ Fluoranthene, su webbook.nist.gov.
- ^ pyrene, su chemister.ru. URL consultato l'11 novembre 2024.
- ^ (EN) PubChem, Pyrene, su pubchem.ncbi.nlm.nih.gov. URL consultato il 4 settembre 2024.
- ^ (EN) PubChem, Pyrene, su pubchem.ncbi.nlm.nih.gov. URL consultato il 16 luglio 2022.
- ^ (EN) Ruben Canton-Vitoria, Yuman Sayed-Ahmad-Baraza e Mario Pelaez-Fernandez, Functionalization of MoS2 with 1,2-dithiolanes: toward donor-acceptor nanohybrids for energy conversion, in npj 2D Materials and Applications, vol. 1, n. 1, 5 giugno 2017, pp. 1–9, DOI:10.1038/s41699-017-0012-8. URL consultato il 4 settembre 2024.
- ^ Valéry Le Page, Yeghis Keheyan e Theodore P Snow, Gas phase chemistry of pyrene and related cations with molecules and atoms of interstellar interest1, in International Journal of Mass Spectrometry, vol. 185-187, 29 aprile 1999, pp. 949–959, DOI:10.1016/S1387-3806(98)14217-3. URL consultato il 2 ottobre 2024.
- ^ (EN) Pyrene, su chemeurope.com. URL consultato il 16 luglio 2022.
- ^ Selim Senkan e Marco Castaldi, Combustion, collana Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2003.
Voci correlate
[modifica | modifica wikitesto]- Antracene
- Fenantrene
- Bifenile
- Naftalene
- Benzopirene
- Idrocarburi policiclici aromatici
- Regola di Clar
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su pirene
Wikimedia Commons contiene immagini o altri file su pirene
| Controllo di autorità | LCCN (EN) sh2002005321 · GND (DE) 4176461-4 · J9U (EN, HE) 987007542263005171 |
|---|