Vinorelbina
| Vinorelbina | |
|---|---|
 | |
| Caratteristiche generali | |
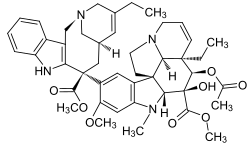
| Formula bruta o molecolare | C45H54N4O8 |
| Massa molecolare (u) | 778.93 g/mol |
| Numero CAS | |
| Codice ATC | L01 |
| PubChem | 5311497 |
| DrugBank | DBDB00361 |
| SMILES | CCC1=CC2CN(C1)Cc1c([nH]c3ccccc13)C(C(=O)OC)(c1cc3c(cc1OC)N(C)C1C(O)(C(=O)OC)C(OC(C)=O)C4(CC)C=CCN5CCC31C54)C2 |
| Dati farmacologici | |
| Modalità di somministrazione | orale, endovenosa |
| Dati farmacocinetici | |
| Biodisponibilità | 43 ± 14%[1] |
| Legame proteico | dal 79 al 91% |
| Metabolismo | epatico |
| Emivita | da 27.7 a 43.6h |
| Escrezione | fecale (46%) e renale (18%) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 317 |
| Consigli P | 280 [2] |
La vinorelbina (nome commerciale Navelbine) è un chemioterapico ad azione antimitotica, utilizzato nella cura di alcuni tipi di cancro, compresi il carcinoma della mammella e il carcinoma polmonare non a piccole cellule.
Farmacologia
[modifica | modifica wikitesto]Vinorelbina è il primo derivato semisintetico 5'NOR degli alcaloidi della vinca. Questa molecola è stata ottenuta per semi-sintesi a partire dagli alcaloidi estratti dalla pervinca rosea, (catharanthus roseus).
Storia
[modifica | modifica wikitesto]Vinorelbina è stata scoperta nel 1980 da Pierre Potier e collaboratori del CNRS Francese e concessa in licenza al Dipartimento di Oncologia del Gruppo Pierre Fabre. Il farmaco è stato approvato in Francia nel 1989, con il marchio Navelbine, per il trattamento del carcinoma del polmone non a piccole cellule. Nel 1991 il farmaco ha ottenuto l'approvazione per il trattamento del carcinoma metastatico della mammella. Nel dicembre 1994, Vinorelbina ha ottenuto l'autorizzazione al commercio negli Stati Uniti dalla Food and Drug Administration (FDA). Nella maggior parte delle Nazioni dell'Unione europea, Vinorelbina è approvata per il trattamento del carcinoma polmonare non a piccole cellule e del carcinoma metastatico della mammella. In Italia, vinorelbina è in commercio dal 1993.
Formulazione orale
[modifica | modifica wikitesto]È stata registrata e commercializzata una formulazione orale nella maggior parte delle nazioni Europee, con le stesse indicazioni della formulazione endovenosa. La formulazione orale di vinorelbina è stata approvata in Italia nel 2003. L'efficacia tra le due formulazioni è risultata sovrapponibile. La formulazione orale evita le tossicità dovute all'infusione e permette una maggiore facilità nell'assunzione della chemioterapia.
Utilizzo
[modifica | modifica wikitesto]Vinorelbina è approvata per il trattamento del carcinoma polmonare non a piccole cellule e per il carcinoma metastatico della mammella. Vinorelbina si è dimostrata anche attiva nel carcinoma testa-collo, nel carcinoma prostatico ormonoresistente, nel carcinoma della cervice uterina, nel carcinoma dell'ovaio, nei linfomi non-hodgikin e nel rabdomiosarcoma.
Effetti collaterali
[modifica | modifica wikitesto]Vinorelbina presenta degli effetti collaterali che potrebbero limitarne l'uso:
- riduzione della difese immunitarie, ematomi o sanguinamento, anemia, stipsi, diarrea, nausea, intorpidimento o formicolio alle mani o ai piedi (neuropatia periferica), stanchezza e sensazione generale di debolezza (astenia), infiammazione della vene in cui è somministrata (flebiti). Raramente è stata riscontrata grave iponatremia.
- effetti collaterali meno comuni sono la perdita dei capelli e reazioni allergiche.
Note
[modifica | modifica wikitesto]- ^ Marty M, Fumoleau P, Adenis A, Rousseau Y, Merrouche Y, Robinet G, Senac I, Puozzo C, Oral vinorelbine pharmacokinetics and absolute bioavailability study in patients with solid tumors, in Ann Oncol, vol. 12, n. 11, 2001, pp. 1643–9, DOI:10.1023/A:1013180903805, PMID 11822766.
- ^ Sigma Aldrich; rev. del 31.08.2012, riferita al tartrato diidrato
Bibliografia
[modifica | modifica wikitesto]- Vinorelbine in previously treated advanced childhood sarcomas: evidence of activity in rhabdomyosarcoma., su ncbi.nlm.nih.gov.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Vinorelbine
Wikimedia Commons contiene immagini o altri file su Vinorelbine