X-gal
| X-gal | |
|---|---|
 | |
| Nome IUPAC | |
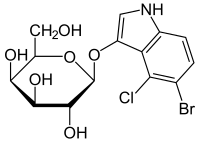
| 5-bromo-4-cloro-3-indolil- beta-D-galattopiranoside | |
| Abbreviazioni | |
| BCIG | |
| Nomi alternativi | |
| X-gal | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C14H15BrClNO6 |
| Massa molecolare (u) | 408,629 |
| Numero CAS | |
| Numero EINECS | 230-640-8 |
| PubChem | 65181 |
| SMILES | C1=CC(=C(C2=C1NC=C2OC3C(C(C(C(O3)CO)O)O)O)Cl)Br |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- [1] |
X-gal (abbreviato anche in BCIG per bromo-cloro-indolil-galattopiranoside) è un composto organico consistente in una molecola di galattosio legata ad un indolo sostituito. È ampiamente utilizzato in biologia molecolare.
Usi
[modifica | modifica wikitesto]Clonaggio
[modifica | modifica wikitesto]Nel clonaggio genico, l'X-gal è utilizzato per indicare quando una cellula esprime l'enzima β-galattosidasi, che è codificato dal gene lacZ, in una tecnica chiamata screening bianco-blu.
L'X-gal viene scisso dalla β-galattosidasi producendo galattosio e 5-bromo-4-cloro-3-idrossindolo. Quest'ultimo è quindi ossidato in 5,5'-dibromo-4,4'-dicloro-indaco, un composto blu insolubile. Quindi, se dell'X-gal ed un induttore della β-galattosidasi (molto utilizzato è l'IPTG) sono aggiunti ad un terreno a base di agarosio in una piastra di coltura, le colonie batteriche con un gene "lacZ" funzionale possono essere distinte dalle altre.
Quando una tecnica per clonare geni tramite vettori plasmidici inseriti in cellule batteriche risulta ottimale, l'X-gal è utilizzato per localizzare visivamente le colonie di lieviti o di Escherichia coli che sono state trasformate dal vettore plasmidico desiderato in uno screening bianco-blu. I batteri E. coli, che non sono in grado di produrre l'enzima β-galattosidasi (codificata dal gene lacZ dell'operone lac), vengono trasformati dall'assorbimento del vettore plasmidico, che contiene un inserto nella regione codificante del gene lacZ. Una volta trasformati, i batteri aventi un plasmide risultano in grado di produrre l'enzima β-galattosidasi che può scindere l'X-gal presente nel terreno a base di agar, dando luogo a delle colonie blu. Le colonie batteriche originate da cellule non trasformate non riescono a scindere l'X-gal, per cui rimangono bianche. I vettori plasmidici possono anche essere codificati per bloccare diversamente la produzione di β-galattosidasi portando le colonie trasformate a sviluppare una colorazione bianca, che diventa blu solo nel caso non portino il plasmide. È il caso di molti vettori di clonazione presenti sul mercato, come il pGem-T Vectors della Promega, che porta lacZα, una forma troncata del gene della β-galattosidasi, e richiede specifici ceppi di E. coli (come DH5α) per ottenere α-complementazione.
"Reporter"
[modifica | modifica wikitesto]Il gene lacZ può essere utilizzato come "reporter" in combinazione con mezzi di coltura contenenti X-gal. Nell'analisi del Doppio Ibrido per esempio, è fondamentale per distinguere tra quali lieviti oppure batteri vi sia stata un'interazione fruttuosa, che porta al legame tra un promotore ed un dominio di attivazione, ed in quali cellule invece questo non sia avvenuto.Se il promotore si è legato ad un gene lacZ, la produzione di β-galattosidasi sarà indicata dalla produzione di pigmento blu da parte delle colonie che hanno avuto una interazione fruttuosa. [2] A causa della sua esecuzione manuale, questa tecnica si utilizza solitamente nelle situazioni in cui il numero di colonie che devono essere distinte è minore di 106. [2] L'avvenuta scissione dell'X-gal produce anche una forte puzza dovuta alla volatilizzazione dell'indolo.
Analisi dell'acqua
[modifica | modifica wikitesto]Oltre all'uso in biologia molecolare, l'X-gal è utilizzato per determinare il contenuto in Escherichia coli ed altri coliformi in campioni di acqua potabile.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 27.04.2012
- ^ a b Joung J, Ramm E, Pabo C, A bacterial two-hybrid selection system for studying protein-DNA and protein-protein interactions, in Proc Natl Acad Sci USA, vol. 97, n. 13, 2000, pp. 7382–7, DOI:10.1073/pnas.110149297, PMC 16554, PMID 10852947.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su X-gal
Wikimedia Commons contiene immagini o altri file su X-gal
