コアクチベーター
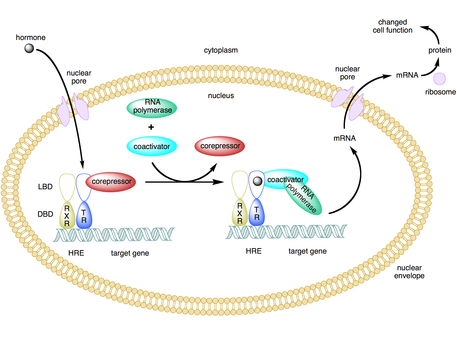
コアクチベーター(英: coactivator)は、アクチベーター(転写因子)に結合して遺伝子の転写率を高める転写コレギュレーターである[1]。アクチベーターにはDNA結合ドメインが存在し、遺伝子のプロモーター部位か、エンハンサーと呼ばれる調節配列に結合する[2][3]。アクチベーター-コアクチベーター複合体は、基本転写装置をプロモーターにリクルートすることで転写の速度を高め、遺伝子発現を高める[3][4][5]。アクチベーターとコアクチベーターを利用することで、細胞種や発生段階に依存して、高度な特異性で特定の遺伝子を発現させることが可能となる[2]。
一部のコアクチベーターは、ヒストンアセチルトランスフェラーゼ(HAT)活性を有する。HATは巨大な多タンパク質複合体を形成し、ヒストンのN末端テールをアセチル化することで、ヒストンのDNAへの結合を弱める。これによって転写装置がプロモーターに結合するための空間はより大きなものとなり、結果として遺伝子発現が増大する[1][4]。
アクチベーターは全ての生物に存在するが、コアクチベータータンパク質は一般的には真核生物のみに存在する。これは真核生物ではより複雑で入り組んだ遺伝子調節が必要となるためであると考えられている[1][4]。コアクチベーターは、核内に局在しているタンパク質であることが多い[1][6]。
機構
[編集]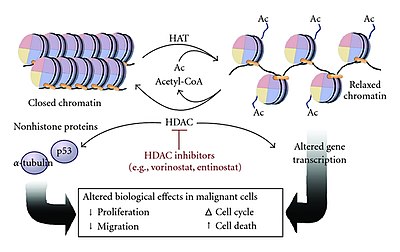
一部のコアクチベーターは、アクチベーターに結合してコンフォメーション変化を誘導し、アクチベーターがDNAのエンハンサーまたはプロモーターの配列に結合できるようにすることで、間接的に遺伝子発現を制御する[2][8][9]。アクチベーター-コアクチベーター複合体がエンハンサーに結合すると、RNAポリメラーゼIIや他の基本転写装置がDNAにリクルートされ、転写が開始される[10]。
ヒストンアセチルトランスフェラーゼ
[編集]核DNAは通常ヒストンの周囲に巻きついており、転写装置がDNAにアクセスすることは困難または不可能である。DNAとヒストンとの結合は主に静電的相互作用によるものであり、DNAのリン酸骨格は負に帯電し、ヒストンは正に帯電したリジン残基に富んでいる[11]。DNAとヒストンとの間の強固な結合はDNAからRNAへの転写を防ぐ。
多くのコアクチベーターにはヒストンアセチルトランスフェラーゼ(HAT)活性が存在し、ヒストンのN末端テールの特定のリジン残基をアセチル化することができる[4][8][12]。アクチベーターはエンハンサー部位に結合してHAT複合体をリクルートし、プロモーターに結合したヒストンの正に帯電したリジン残基をアセチル化によって中和する[8][12]。この電荷の中和によって、負に帯電したDNAに対するヒストンの結合が弱められてクロマチン構造は緩和され、他の転写因子や転写装置がプロモーターに結合できるようになる[4][12]。HAT複合体によるアセチル化は転写伸長過程でのクロマチンが開いた状態の維持にも寄与し、転写速度を上昇させる[4]。

タンパク質のN末端のアセチル化は真核生物で最も一般的なタンパク質修飾の1つであり、ヒトのタンパク質の約85%がアセチル化されている[13]。アセチル化はタンパク質やRNA転写産物の合成、安定性、機能、調節、そして局在に重要である[12][13]。
HATの機能はこうしたN末端アセチルトランスフェラーゼ(NAT)と類似しているが、HATによるアセチル化はNATによるものとは異なり可逆的である[14]。HATを介したヒストンのアセチル化に対してはヒストンデアセチラーゼ(HDAC)による逆反応が行われ、HDACはリジン残基を加水分解してヒストンからアセチル基を除去する[4][8][12]。これによってクロマチンは緩和状態から閉じた状態となり、転写装置のプロモーターへの結合が困難になって遺伝子発現は抑制される[4][8]。
HAT活性を示すコアクチベーターとしては、CARM1、CBP、EP300などがある[15][16]。
共抑制
[編集]多くのコアクチベーターは特定の条件下ではコリプレッサーとしても機能する[5][10]。TAF1やBTAF1などのコファクターはアクチベーター存在下では転写を開始し(コアクチベーターとしての作用)、アクチベーター非存在下では基本的な転写を抑制する(コリプレッサーとしての作用)[10]。
意義
[編集]生物学的意義
[編集]転写調節は、生物が遺伝子発現を変化させる最も一般的な方法の1つである[17]。アクチベーターとコアクチベーターの利用は、いつ、どこで、どれだけのタンパク質を産生するかについて、より多くの制御を可能にする[1][8][17]。これによって、各細胞は環境変化や生理的変化に迅速に応答し、調節がなければ生じてしまうような損傷を軽減することが可能となる[1][8]。
関係する疾患
[編集]コアクチベーターの遺伝子の突然変異はタンパク質の機能の獲得または損失をもたらし、先天性疾患、がん(特にホルモン依存性のがん)、神経発達症、知的障害など多くの疾患と関係している[5][18]。コアクチベーターの過剰発現や発現低下をもたらす調節異常は多くの薬剤(特に抗ホルモン剤)との相互作用に悪影響を与え、がん、不妊、神経発達症、精神障害への関与が示唆されている[5]。具体例としては、中枢神経系、生殖系、胸腺、腎臓で多数の転写因子のコアクチベーターとして機能するCREB結合タンパク質は、ハンチントン病、白血病、ルビンシュタイン・テイビ症候群、神経発達症、免疫系や造血、骨格筋機能の欠陥と関連している[15][19]。
薬剤標的として
[編集]コアクチベーターは、がん、代謝異常、心血管疾患、2型糖尿病などに対する薬物治療の有望な標的である[5][20]。例えば、ステロイドホルモン受容体のコアクチベーターであるNCOA3は乳がんでしばしば過剰発現しているため、このコアクチベーターを標的とする阻害剤の開発によって発現を低下させることができれば、乳がんの治療法として利用できる可能性がある[16][21]。
既知のコアクチベーター
[編集]現在300種類の転写コレギュレーターが知られている[16]。コアクチベーターの一部を次に挙げる[22]。
- ARA54はアンドロゲン受容体を標的とする。
- ATXN7L3は核内受容体スーパーファミリーのいくつかを標的とする。
- BCL3はレチノイドX受容体(RXR)を標的とする。
- CBPは多くの転写因子を標的とする。
- CDC25Bはステロイドホルモン受容体を標的とする。
- COPS5はいくつかの核内受容体を標的とする。
- DDCはアンドロゲン受容体を標的とする。
- EP300は多くの転写因子を標的とする。
- KAT5は多くの核内受容体を標的とする。
- KDM1Aはアンドロゲン受容体を標的とする
- ステロイド受容体コアクチベーターファミリー
出典
[編集]- ^ a b c d e f Courey, Albert J. (2008). Mechanisms in transcriptional regulation. Malden, MA: Blackwell. ISBN 978-1-4051-0370-1. OCLC 173367793
- ^ a b c “General transcription factor / transcription factor”. Learn Science at Scitable. 2017年11月29日閲覧。
- ^ a b “Enhancers: five essential questions”. Nature Reviews Genetics 14 (4): 288–95. (April 2013). doi:10.1038/nrg3458. PMC 4445073. PMID 23503198.
- ^ a b c d e f g h “The many HATs of transcription coactivators”. Trends in Biochemical Sciences 25 (1): 15–9. (January 2000). doi:10.1016/S0968-0004(99)01516-9. PMID 10637607.
- ^ a b c d e Kumar, Rakesh; O'Malley, Bert W. (2008). NR coregulators and human diseases. Hackensack, N.J.: World Scientific. ISBN 978-981-270-536-5. OCLC 261137374
- ^ “Coactivators and general transcription factors have two distinct dynamic populations dependent on transcription”. The EMBO Journal 36 (18): 2710–2725. (September 2017). doi:10.15252/embj.201696035. PMC 5599802. PMID 28724529.
- ^ Lansigan, Frederick; Foss, Francine M. (2010-02-12). “Current and emerging treatment strategies for cutaneous T-cell lymphoma”. Drugs 70 (3): 273–286. doi:10.2165/11532190-000000000-00000. ISSN 1179-1950. PMID 20166766.
- ^ a b c d e f g “Biological control through regulated transcriptional coactivators”. Cell 119 (2): 157–67. (October 2004). doi:10.1016/j.cell.2004.09.037. PMID 15479634.
- ^ “Molecular Dynamics of "Fuzzy" Transcriptional Activator-Coactivator Interactions”. PLOS Computational Biology 12 (5): e1004935. (May 2016). Bibcode: 2016PLSCB..12E4935S. doi:10.1371/journal.pcbi.1004935. PMC 4866707. PMID 27175900.
- ^ a b c “The general transcription machinery and general cofactors”. Critical Reviews in Biochemistry and Molecular Biology 41 (3): 105–78. (May 2006). doi:10.1080/10409230600648736. PMID 16858867.
- ^ Decher, Gero (1997-08-29). “Fuzzy Nanoassemblies: Toward Layered Polymeric Multicomposites” (英語). Science 277 (5330): 1232–1237. doi:10.1126/science.277.5330.1232. ISSN 0036-8075.
- ^ a b c d e “Nuclear receptor coregulators: multiple modes of modification”. Trends in Endocrinology and Metabolism 13 (2): 55–60. (2002). doi:10.1016/s1043-2760(01)00527-6. PMID 11854019.
- ^ a b “NatF contributes to an evolutionary shift in protein N-terminal acetylation and is important for normal chromosome segregation”. PLOS Genetics 7 (7): e1002169. (July 2011). doi:10.1371/journal.pgen.1002169. PMC 3131286. PMID 21750686.
- ^ “Protein N-terminal acetyltransferases: when the start matters”. Trends in Biochemical Sciences 37 (4): 152–61. (April 2012). doi:10.1016/j.tibs.2012.02.003. PMID 22405572.
- ^ a b “Nuclear receptor coregulators: modulators of pathology and therapeutic targets”. Nature Reviews. Endocrinology 8 (10): 598–604. (October 2012). doi:10.1038/nrendo.2012.100. PMC 3564250. PMID 22733267.
- ^ a b c “Nuclear receptor coregulators as a new paradigm for therapeutic targeting”. Advanced Drug Delivery Reviews 62 (13): 1227–37. (October 2010). doi:10.1016/j.addr.2010.09.016. PMC 5004779. PMID 20933027.
- ^ a b “Enhancer”. Learn Science at Scitable. 2017年11月29日閲覧。
- ^ Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul T.; Baltimore, David; Darnell, James (2000). Molecular Cell Biology (4th ed.). New York: W.H. Freeman. ISBN 978-0-7167-3136-8. OCLC 41266312
- ^ Becnel, LB; Darlington, YF; Orechsner, S; Easton-Marks, J; Watkins, CA; McOwiti, A; Kankanamge, WH; Dehart, M et al.. “CBP”. NURSA Molecules. doi:10.1621/8egsudafco.
- ^ “Nuclear Receptors”. courses.washington.edu. 2017年11月29日閲覧。
- ^ “Steroid receptor coactivator-3 as a potential molecular target for cancer therapy”. Expert Opinion on Therapeutic Targets 16 (11): 1085–96. (November 2012). doi:10.1517/14728222.2012.718330. PMC 3640986. PMID 22924430.
- ^ “NURSA - Molecules” (英語). nursa.org. 2017年11月30日閲覧。
関連項目
[編集]外部リンク
[編集]- Nuclear Receptor Signalling Atlas (NIH-funded research consortium and database; includes open-access PubMed-indexed journal, Nuclear Receptor Signaling)
- TcoF - Dragon database of transcription co-factors and transcription factor interacting proteins