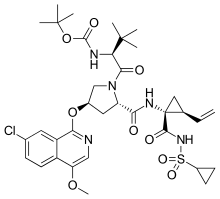
アスナプレビル
 | |
| 臨床データ | |
|---|---|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 9.3% |
| 血漿タンパク結合 | 99.8% |
| 代謝 | CYP3A4、CYP3A5 |
| 半減期 | 15.4〜21.2 時間 |
| 排泄 | 糞 |
| データベースID | |
| PubChem | CID: 16076883 |
| ChemSpider | 17235944 |
| KEGG | D10093 |
| ChEMBL | CHEMBL2105735 |
| 化学的データ | |
| 化学式 | C35H46ClN5O9S |
| 分子量 | 748.29 g·mol−1 |
| |
| |
アスナプレビル(Asunaprevir)はC型肝炎経口治療薬の一つである。商品名スンベプラ。日本ではダクラタスビルとの併用療法が臨床試験に付され[1] 、2015年3月に承認された[2]。アスナプレビルはC型肝炎ウイルスの酵素セリンプロテアーゼNS3/4Aの阻害剤である[3]。開発コードBMS-650032。なお日本での販売は2021年に中止された。
効能・効果
[編集]セログループ1(ジェノタイプ1)のC型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善
禁忌
[編集]アスナプレビルは下記の患者には禁忌である[4]。
- 製剤の成分に過敏症の既往歴のある患者
- 中等度以上(Child-Pugh分類BまたはC)の肝機能障害 または 非代償性肝疾患 のある患者
- 下記の薬剤・食品を使用中の患者
- アゾール系抗真菌剤(経口または注射剤)
- クラリスロマイシン
- エリスロマイシン
- ジルチアゼム
- ベラパミル塩酸塩
- コビシスタット含有製剤
- HIVプロテアーゼ阻害剤
- 血中濃度が増加する
- リファンピシン
- リファブチン
- フェニトイン
- カルバマゼピン
- フェノバルビタール
- デキサメタゾン全身投与
- モダフィニル
- 非ヌクレオシド系逆転写酵素阻害剤(リルピビリン塩酸塩を除く)
- ボセンタン水和物
- セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品
- 血中濃度が低下する
- シクロスポリン
- アスナプレビルの肝臓での取り込みが減少する
- フレカイニド
- プロパフェノン
- これらの薬剤のCYP2D6による代謝が阻害される
慎重投与
[編集]- 重度の腎機能障害患者で血液透析を行っていない場合は、血中濃度が上昇することがある。
- B型肝炎ウイルス感染の患者または既往感染者では、ウイルスが再活性化される場合がある。
副作用
[編集]添付文書に記載されている重大な副作用は、ALT(GPT)増加、AST(GOT)増加、血中ビリルビン増加、多形紅斑、血小板減少、間質性肺炎である[4]。
これらの内、ALT(GPT)増加の発現率が17.4%、AST(GOT)増加の発現率が14.4%であるほか、好酸球増加症、発熱、倦怠感、頭痛、下痢、悪心が5%以上に発現する。
臨床試験
[編集]アスナプレビルはダクラタスビルとの併用のほか、ペグインターフェロンとリバビリンとの3剤併用療法が試験された[5][6][7]。
日本では、第I相臨床試験(単回投与、反復投与)のほか、次の第IIa相臨床試験と第III相臨床試験が実施された。
AI447017試験(第IIa相)
[編集]インターフェロンを含む治療に不適格、不忍容、無反応のジェノタイプ1のC型慢性肝炎患者43名を対象にアスナプレビル(ASV)+ダクラタスビル(DCV)を24週間投与した。24週後のウイルス学的著効率(SVR24)は76.7%であった[8]:17。副作用発現率は93.0%であった。
AI447031試験(第III相)
[編集]インターフェロン(IFN)を含む治療に適格のジェノタイプ1b未治療患者を対象に、ASV+DCV(119名)またはIFN/RBV(リバビリン)+テラプレビル(TVR)(111名)を投与した。SVR24はASV+DCV群で86.6%、IFN/RBV+TVR群で60.4%であり、非劣性が示された[8]:18。
また、前治療再燃患者(22名)にASV+DCVを投与した結果のSVR24は90.9%であった。
副作用発現率は58.9%であった。
AI447026試験(第III相)
[編集]ジェノタイプ1bのC型慢性肝炎患者222名にASV+DCVを投与した結果、SVR24は84.7%であった[8]:21。
副作用発現率は57.7%であった。
関連項目
[編集]出典
[編集]- ^ “A Phase 3 Study in Combination With BMS-790052 and BMS-650032 in Japanese Hepatitis C Virus (HCV) Patients”. ClinicalTrials.gov. 2015年5月21日閲覧。
- ^ “2種類の経口抗ウイルス剤「ダクルインザ錠60mg」「スンベプラカプセル100mg」:経口薬のみによるC型慢性肝炎/代償性肝硬変の治療が日本人で最も多いジェノタイプ1の全ての患者さんで選択肢となる”. ブリストル・マイヤーズ (2015年3月20日). 2015年5月21日閲覧。
- ^ C. Reviriego (2012). “Asunaprevir. HCV serine protein NS3 inhibitor, Treatment of hepatitis C virus”. Drugs of the Future 37 (4): 247–254. doi:10.1358/dof.2012.37.4.1789350.
- ^ a b “スンベプラカプセル100mg 添付文書” (2016年5月). 2016年6月16日時点のオリジナルよりアーカイブ。2016年6月30日閲覧。
- ^ Lok, A et al. (2012). “Preliminary Study of Two Antiviral Agents for Hepatitis C Genotype 1”. New England Journal of Medicine 366 (3): 216–224. doi:10.1056/NEJMoa1104430.
- ^ “Bristol-Myers' Daclatasvir, Asunaprevir Cured 77%: Study”. Bloomberg (2012年4月19日). 2015年5月21日閲覧。
- ^ AASLD: Daclatasvir plus Asunaprevir Rapidly Suppresses HCV in Prior Null Responders. Highleyman, L. HIVandHepatitis.com. 8 November 2011.
- ^ a b c “スンベプラカプセル100mg インタビューフォーム”. ブリストル・マイヤーズ (2015年4月). 2015年5月21日閲覧。