イキサゾミブ
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Ninlaro |
| Drugs.com | entry |
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 58%[1] |
| 血漿タンパク結合 | 99% |
| 代謝 | Hepatic (CYP: 3A4 (42%), 1A2 (26%), 2B6 (16%) and others) |
| 半減期 | 9.5 days |
| 排泄 | Urine (62%), feces (22%) |
| データベースID | |
| CAS番号 | 1072833-77-2 |
| ATCコード | L01XX50 (WHO) |
| PubChem | CID: 25183872 |
| ChemSpider | 25027391 |
| UNII | 71050168A2 |
| KEGG | D10130 |
| ChEBI |
CHEBI:90942 |
| 別名 | MLN2238 |
| 化学的データ | |
| 化学式 | C14H19BCl2N2O4 |
| 分子量 | 361.03 g·mol−1 |
| |
| |
 | |
| データベースID | |
|---|---|
| CAS番号 | 1239908-20-3 |
| ATCコード | L01XG03 (WHO) |
| PubChem | CID: 135626849 |
| KEGG | D10131 |
| ChEBI | CHEBI:90939 |
| ChEMBL | CHEMBL3545432 |
| 化学的データ | |
| 化学式 | C20H23BCl2N2O9 |
| 分子量 | 517.1216 |
| |
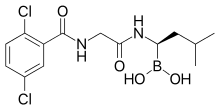
イキサゾミブ (英語: Ixazomib) は、経口プロテアソーム阻害剤の一つである。再発・難治性の多発性骨髄腫治療薬。ホウ酸基をクエン酸で環状に包み込んだイキサゾミブクエン酸エステルが製剤に用いられている。週1回の服薬で効果が期待できる[2]。開発コードMLN9708。
米国では2015年7月に承認申請され[3]、同年9月に優先審査指定され[4]、同年11月に承認された[5]。欧州では2015年8月に販売許可申請が受理された[6]。日本では2016年2月に希少疾病用医薬品に指定され[7]、2017年3月に承認された[8]。
効能・効果
[編集]- 再発又は難治性の多発性骨髄腫
- 多発性骨髄腫における自家造血幹細胞移植後の維持療法
副作用
[編集]重大な副作用には、以下のものが挙げられている[9]。
- 血小板減少症(19.5%)
- 重度の下痢(3.3%)
- 皮膚粘膜眼症候群(Stevens-Johnson症候群)
- 末梢神経障害〔末梢性感覚ニューロパチー(10.7%)、末梢性ニューロパチー(7.4%)、多発ニューロパチー(3.2%)、末梢性感覚運動ニューロパチー(1%未満)等〕
- 可逆性後白質脳症症候群
- 感染症(27.2%)〔帯状疱疹(5.4%)、肺炎(4.2%)等〕
その他。下痢(26.0%)、悪心(25.6%)や嘔吐、便秘、好中球減少症、疲労、発疹 が10%以上に出現する。
作用機序
[編集]イキサゾミブは、治療濃度において、プロテアソームサブユニットβタイプ5(PSMB5)[10]を選択的かつ可逆的に阻害し、解離半減期は18分である。このメカニズムは、解離半減期が110分と非常に長いボルテゾミブと同じである。一方、類薬であるカルフィルゾミブは、PSMB5を不可逆的に阻害する。プロテアソームサブユニットβタイプ1およびタイプ2は、細胞培養モデルで到達し得る高濃度でのみ阻害される[11]。
PSMB5は、20Sプロテアソーム複合体の一部であり、キモトリプシンと同様の酵素活性を有する。様々な癌細胞株において、プログラムされた細胞死の一種であるアポトーシスを誘導する。多くの骨髄腫細胞株において、イキサゾミブとレナリドミドの相乗効果が確認されている[10][12]。
薬物動態
[編集]この薬は、ホウ酸エステルであるプロドラッグ-イキサゾミブクエン酸エステルの形で経口投与される。このエステルは生理的条件下で速やかに加水分解され、生物学的活性型であるイキサゾミブとなる[1]。イキサゾミブの絶対的バイオアベイラビリティは58%で、血漿中最高濃度には1時間後に到達する。血漿タンパク結合率は99%である[13][10]。
この物質は、臨床用量では主に非CYP系酵素で代謝される[14]:51。またより高濃度では多くのCYP酵素によって代謝される(in vitro での割合:CYP3A4 42.3%、CYP1A2 26.1%、CYP2B6 16.0%、CYP2C8 6.0%、CYP2D6 4.8%、CYP2C19 4.8%、CYP2C9 1%未満)事から、相互作用の可能性は低いと考えられる。クリアランスは1時間当たり約1.86リットルで、個人差は44%と大きく、血漿半減期は9.5日であった。イキサゾミブ及びその代謝物の62%が尿中に(うち未変化体は3.5%未満)、22%が糞便中に排泄される[13][10]。
構造
[編集]N-末端を保護されたジペプチドであり、2,5-ジクロロ安息香酸―グリシン―“カルボン酸をホウ酸に置換したロイシン”の順で結合している。クエン酸エステルは、クエン酸β位のカルボン酸およびアルコール基がホウ酸基と縮合して5員環を形成している。
出典
[編集]- ^ a b “Ninlaro (ixazomib) Capsules, for Oral Use. Full Prescribing Information”. NINLARO (ixazomib) For Healthcare Professionals. Takeda Pharmaceutical Company Limited. 21 November 2015閲覧。
- ^ “「イキサゾミブ」の再発・難治性の多発性骨髄腫を対象とする販売許可をFDAに申請-武田薬品”. 参天製薬. 2015年7月22日閲覧。
- ^ “新規経口プロテアソーム阻害薬イキサゾミブの再発・難治性の多発性骨髄腫を対象とした米国における販売許可申請について”. 武田薬品工業 (2015年7月15日). 2015年7月22日閲覧。
- ^ “武田薬品 「イキサゾミブ」、米国で優先審査指定に”. 医薬経済社 (2015年9月10日). 2015年9月10日閲覧。
- ^ “新規経口プロテアソーム阻害薬「NINLARO」(一般名:イキサゾミブ)の米国における販売許可取得について”. 武田薬品工業 (2015年11月21日). 2016年5月28日閲覧。
- ^ “新規経口プロテアソーム阻害薬イキサゾミブの再発・難治性の多発性骨髄腫を対象とした販売許可申請の欧州当局の受理について”. 武田薬品工業 (2015年8月21日). 2015年8月24日閲覧。
- ^ “新規経口プロテアソーム阻害薬イキサゾミブの日本における希少疾病用医薬品の指定について”. 武田薬品工業 (2016年2月26日). 2016年5月28日閲覧。
- ^ “厚労省 新薬10成分23品目を承認 武田の多発性骨髄腫薬ニンラーロなど | ニュース | ミクスOnline”. www.mixonline.jp. 2021年5月11日閲覧。
- ^ “ニンラーロカプセル2.3mg/ニンラーロカプセル3mg/ニンラーロカプセル4mg 添付文書”. www.pmda.go.jp. PMDA. 2021年5月11日閲覧。
- ^ a b c d (German) Austria-Codex. Vienna: Österreichischer Apothekerverlag. (2016)
- ^ “Spotlight on ixazomib: potential in the treatment of multiple myeloma”. Drug Design, Development and Therapy 10: 217–26. (2016). doi:10.2147/DDDT.S93602. PMC 4714737. PMID 26811670.
- ^ KEGG: Ixazomib
- ^ a b “Ninlaro: EPAR – Product Information”. European Medicines Agency (21 November 2016). 2021年5月11日閲覧。
- ^ “ニンラーロカプセル2.3mg/ニンラーロカプセル3mg/ニンラーロカプセル4mg インタビューフォーム”. PMDA. 2021年5月11日閲覧。