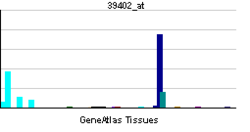
インターロイキン-1β
インターロイキン-1β(英: interleukin 1 beta、略称: IL-1β)はヒトではIL1B遺伝子にコードされるサイトカインで、leukocytic pyrogen、leukocytic endogenous mediator、mononuclear cell factor、lymphocyte activating factorなどの名称でも知られていた[5][6][7][8]。インターロイキン-1(IL-1)には2つの遺伝子が存在し、それぞれIL-1αとIL-1βをコードしている。IL-1β前駆体は細胞質のカスパーゼ1によって切断され、成熟したIL-1βが形成される。
機能
[編集]発熱作用をもつヒト白血球性発熱物質(インターロイキン-1)は、1977年にDinarelloらによって精製された[9]。1979年、Dinarelloは精製されたヒト白血球性発熱物質が1972年にIgal Geryによって記載されていた分子と同一であることを報告した[10][11][12][13]。この物質はリンパ球の分裂促進因子であるため、lymphocyte-activating factor(LAF)と名付けられた。1984年になってインターロイキン-1が2つの異なるタンパク質から構成されていることが発見され、現在ではそれらはインターロイキン-1α(IL-1α)とインターロイキン-1β(IL-1β)と呼ばれている[6]。
IL-1βはインターロイキン-1ファミリーのメンバーのサイトカインである。このサイトカインは活性化されたマクロファージによって前駆体タンパク質として産生され、カスパーゼ1(CASP1/ICE)によるタンパク質分解によって活性型へとプロセシングされる。IL-1βは炎症反応の重要な媒介因子であり、細胞増殖、細胞分化、アポトーシスを含むさまざまな活性に関与している。中枢神経系におけるIL-1βによるシクロオキシゲナーゼ2(PTGS2/COX2)の誘導は、炎症性痛覚過敏に寄与することが判明している。この遺伝子や他のIL-1ファミリーの8つの遺伝子は、2番染色体でサイトカイン遺伝子クラスターを形成している[14]。
IL-1βは、IL-23とともに、γδT細胞によるIL-17、IL-21、IL-22の発現を誘導する。この発現誘導は他のシグナルがなくとも起こり、IL-1βが自己免疫の調節に関与していることが示唆される[15]。
これまでにさまざまなインフラマソーム複合体(細胞質の分子複合体)が記載されている。インフラマソームは危険シグナルを認識し、IL-1β、IL-18の産生と炎症促進過程を活性化する。NLRP3型インフラマソームはさまざまな刺激によって活性化され、2型糖尿病、アルツハイマー病、肥満、アテローム性動脈硬化などいくつかの疾患との関連が記載されている[16]。
性質
[編集]タンパク質分解によるプロセシングを受けたIL-1βは 17.5 kDaであり、次のアミノ酸配列を持つ。
- APVRSLNCTL RDSQQKSLVM SGPYELKALH LQGQDMEQQV VFSMSFVQGE ESNDKIPVAL GLKEKNLYLS CVLKDDKPTL QLESVDPKNY PKKKMEKRFV FNKIEINNKL EFESAQFPNW YISTSQAENM PVFLGGTKGG QDITDFTMQF VSS
マウスD10S細胞に対する用量依存的な細胞増殖効果によって決定された生理学的活性は、2.5–7.1x108 units/mgである。
臨床的意義
[編集]IL-1βの産生の増加は多数の自己免疫疾患を引き起こすが、最も顕著なものとしてクリオピリン関連周期熱症候群と呼ばれる、IL-1βのプロセシングを開始させるインフラマソーム受容体NLRP3の変異を原因とする単一遺伝子疾患が挙げられる[17]。カナキヌマブはIL-1βを標的としたヒトモノクローナル抗体であり、多くの国でクリオピリン関連周期熱症候群の治療に対して承認が行われている。
腸内細菌叢の異常(dysbiosis)は、IL-1β依存的に骨髄炎を誘導することが報告されている[18]。
IL-1βは多発性硬化症の患者の中枢神経系にも存在していることが判明している。しかし、どの細胞がIL-1βを産生しているのかは正確には解明されていない。グラチラマー酢酸塩やナタリズマブによる多発性硬化症の治療によって、IL-1βやその受容体が減少することが示されている[19]。
発がんにおけるインフラマソームとIL-1βの役割
[編集]いくつかのタイプのインフラマソームは免疫調節、腸内細菌叢の調整、分化、アポトーシスに関与しているため、腫瘍形成に何らかの役割を果たしていると示唆されている。インフラマソームによって引き起こされたIL-1βの過剰発現は発がんにつながる可能性がある。いくつかのデータは、NLRP3インフラマソームの多型と結腸がんや悪性黒色腫などの悪性腫瘍との関係を示唆している。肺腺がん細胞株A549ではIL-1βの分泌が上昇していることが報告されている。他の研究では、インフラマソームとIL-1βの発現阻害によって悪性黒色腫でのがん細胞の発生が減少することが示されている[20]。IL-1βががんにおける化学療法耐性を促進し、腫瘍の微小環境において重要な役割を果たしていることが知られています。[21][22]
網膜変性
[編集]IL-1ファミリーは、加齢黄斑変性症、糖尿病網膜症、網膜色素変性症など、多くの変性疾患における炎症反応に重要な役割を果たしていることが示されている。糖尿病網膜症の患者の硝子体ではIL-1βタンパク質のレベルが大きく上昇している。IL-1βの役割について、糖尿病網膜症の治療標的としての可能性が研究されている。一方、カナキヌマブの全身投与では大きな効果はみられない。加齢黄斑変性症におけるIL-1βの役割は患者では証明されていないものの、多くの動物モデルやin vitroの研究からは、網膜色素上皮細胞や光受容細胞の損傷における役割が示されている。NLRP3インフラマソームは、細胞質のIL-1β前駆体を成熟型であるIL-1βへ切断するカスパーゼ1を活性化する。網膜色素上皮細胞はヒトの網膜において血液網膜関門を形成しており、これは網膜の代謝活性、完全性、免疫細胞の浸潤の阻害に重要である。酸化ストレスにさらされたヒトの網膜色素上皮細胞はIL-1βを分泌する。炎症反応は網膜細胞の損傷と免疫系の細胞の浸潤を引き起こす。NLRP3のアップレギュレーションなどの炎症過程は加齢黄斑変性症や他の網膜疾患の原因の1つであり、失明へとつながる[23][24][25]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000125538 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000027398 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Nucleotide sequence of human monocyte interleukin 1 precursor cDNA”. Proceedings of the National Academy of Sciences of the United States of America 81 (24): 7907–11. (December 1984). Bibcode: 1984PNAS...81.7907A. doi:10.1073/pnas.81.24.7907. PMC 392262. PMID 6083565.
- ^ a b March, C. J.; Mosley, B.; Larsen, A.; Cerretti, D. P.; Braedt, G.; Price, V.; Gillis, S.; Henney, C. S. et al. (1985 Jun 20-26). “Cloning, sequence and expression of two distinct human interleukin-1 complementary DNAs”. Nature 315 (6021): 641–647. doi:10.1038/315641a0. ISSN 0028-0836. PMID 2989698.
- ^ “Genomic sequence for human prointerleukin 1 beta: possible evolution from a reverse transcribed prointerleukin 1 alpha gene”. Nucleic Acids Research 14 (20): 7897–914. (October 1986). doi:10.1093/nar/14.20.7897. PMC 311823. PMID 3490654.
- ^ “Human interleukin-1 beta gene”. Gene 52 (1): 95–101. (1987). doi:10.1016/0378-1119(87)90398-2. PMID 2954882.
- ^ Dinarello, C. A.; Renfer, L.; Wolff, S. M. (1977-10). “Human leukocytic pyrogen: purification and development of a radioimmunoassay”. Proceedings of the National Academy of Sciences of the United States of America 74 (10): 4624–4627. doi:10.1073/pnas.74.10.4624. ISSN 0027-8424. PMC 431999. PMID 22079.
- ^ “Potentiation of the T-lymphocyte response to mitogens. I. The responding cell”. The Journal of Experimental Medicine 136 (1): 128–42. (July 1972). doi:10.1084/jem.136.1.128. PMC 2139184. PMID 5033417.
- ^ “Potentiation of the T-lymphocyte response to mitogens. II. The cellular source of potentiating mediator(s)”. The Journal of Experimental Medicine 136 (1): 143–55. (July 1972). doi:10.1084/jem.136.1.143. PMC 2139186. PMID 5033418.
- ^ “Potentiation of the T lymphocyte response to mitogens. III. Properties of the mediator(s) from adherent cells”. Cellular Immunology 11 (1–3): 162–9. (March 1974). doi:10.1016/0008-8749(74)90016-1. PMID 4549027.
- ^ Rosenwasser, L. J.; Dinarello, C. A.; Rosenthal, A. S. (1979-09-19). “Adherent cell function in murine T-lymphocyte antigen recognition. IV. Enhancement of murine T-cell antigen recognition by human leukocytic pyrogen”. The Journal of Experimental Medicine 150 (3): 709–714. doi:10.1084/jem.150.3.709. ISSN 0022-1007. PMC 2185642. PMID 314491.
- ^ “Entrez Gene: IL1B interleukin 1, beta”. 2020年5月2日閲覧。
- ^ Sutton, Caroline E.; Lalor, Stephen J.; Sweeney, Cheryl M.; Brereton, Corinna F.; Lavelle, Ed C.; Mills, Kingston H. G. (2009-08-21). “Interleukin-1 and IL-23 induce innate IL-17 production from gammadelta T cells, amplifying Th17 responses and autoimmunity”. Immunity 31 (2): 331–341. doi:10.1016/j.immuni.2009.08.001. ISSN 1097-4180. PMID 19682929.
- ^ “NLRP3 inflammasome: from a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases”. Redox Biology 4: 296–307. (April 2015). doi:10.1016/j.redox.2015.01.008. PMC 4315937. PMID 25625584.
- ^ “Horror autoinflammaticus: the molecular pathophysiology of autoinflammatory disease (*)”. Annual Review of Immunology 27: 621–68. (2009). doi:10.1146/annurev.immunol.25.022106.141627. PMC 2996236. PMID 19302049.
- ^ “Dietary modulation of the microbiome affects autoinflammatory disease”. Nature 516 (7530): 246–9. (December 2014). Bibcode: 2014Natur.516..246L. doi:10.1038/nature13788. PMC 4268032. PMID 25274309.
- ^ “New Insights into the Role of IL-1β in Experimental Autoimmune Encephalomyelitis and Multiple Sclerosis”. Journal of Immunology 198 (12): 4553–4560. (June 2017). doi:10.4049/jimmunol.1700263. PMC 5509030. PMID 28583987.
- ^ “Role of the NLRP3 inflammasome in cancer”. Molecular Cancer 17 (1): 158. (November 2018). doi:10.1186/s12943-018-0900-3. PMC 6240225. PMID 30447690.
- ^ Milosevic, Vladan; Kopecka, Joanna; Salaroglio, Iris C.; Libener, Roberta; Napoli, Francesca; Izzo, Stefania; Orecchia, Sara; Ananthanarayanan, Preeta et al. (2020-01). “Wnt/IL‐1β/IL‐8 autocrine circuitries control chemoresistance in mesothelioma initiating cells by inducing ABCB5” (英語). International Journal of Cancer 146 (1): 192–207. doi:10.1002/ijc.32419. ISSN 0020-7136.
- ^ Rébé, Cédric; Ghiringhelli, François (2020-07). “Interleukin-1β and Cancer” (英語). Cancers 12 (7): 1791. doi:10.3390/cancers12071791. ISSN 2072-6694. PMC PMC7408158. PMID 32635472.
- ^ “Distinct CD40L receptors mediate inflammasome activation and secretion of IL-1β and MCP-1 in cultured human retinal pigment epithelial cells”. Experimental Eye Research 170: 29–39. (May 2018). doi:10.1016/j.exer.2018.02.014. PMC 5924621. PMID 29454857.
- ^ “NLRP3 inflammasome activation in retinal pigment epithelial cells by lysosomal destabilization: implications for age-related macular degeneration”. Investigative Ophthalmology & Visual Science 54 (1): 110–20. (January 2013). doi:10.1167/iovs.12-10655. PMC 3544415. PMID 23221073.
- ^ “IL-1 Family Members Mediate Cell Death, Inflammation and Angiogenesis in Retinal Degenerative Diseases”. Frontiers in Immunology 10: 1618. (2019-07-16). doi:10.3389/fimmu.2019.01618. PMC 6646526. PMID 31379825.
関連文献
[編集]- “Role of the pro-inflammatory cytokines tumor necrosis factor-alpha, interleukin-1 beta, interleukin-6 and interleukin-8 in the pathogenesis of the otitis media with effusion”. European Cytokine Network 13 (2): 161–72. (2003). PMID 12101072.
- “Interleukin-1 in the genesis and progression of and risk for development of neuronal degeneration in Alzheimer's disease”. Journal of Leukocyte Biology 72 (2): 233–8. (August 2002). PMC 3835694. PMID 12149413.
- “The balance between IL-1 and IL-1Ra in disease”. Cytokine & Growth Factor Reviews 13 (4–5): 323–40. (2003). doi:10.1016/S1359-6101(02)00020-5. PMID 12220547.
- “Ethnic differences in allele distribution for the IL8 and IL1B genes in populations from eastern India”. Human Biology 76 (1): 153–9. (February 2004). doi:10.1353/hub.2004.0016. PMID 15222686.
- “Nef: "necessary and enforcing factor" in HIV infection”. Current HIV Research 3 (1): 87–94. (January 2005). doi:10.2174/1570162052773013. PMID 15638726.
- “Role of interleukin-1beta in the development of malnutrition in chronic renal failure patients”. Blood Purification 23 (4): 275–81. (2005). doi:10.1159/000086012. PMID 15925866.
- “Levels of IL-1 beta control stimulatory/inhibitory growth of cancer cells”. Frontiers in Bioscience 11: 889–98. (January 2006). doi:10.2741/1845. PMID 16146780.
- “Modulation of HIV-1 transcription by cytokines and chemokines”. Mini Reviews in Medicinal Chemistry 5 (12): 1093–101. (December 2005). doi:10.2174/138955705774933383. PMID 16375755.
- “H pylori and gastric cancer: shifting the global burden”. World Journal of Gastroenterology 12 (34): 5458–64. (September 2006). doi:10.3748/wjg.v12.i34.5458. PMC 4088226. PMID 17006981.
- “Interleukin-1B polymorphisms and gastric cancer risk--a meta-analysis”. Cancer Epidemiology, Biomarkers & Prevention 15 (10): 1920–8. (October 2006). doi:10.1158/1055-9965.EPI-06-0267. PMID 17035400.
関連項目
[編集]外部リンク
[編集]- IL1B protein, human - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス