ウイルス侵入

・侵入
・複製
・潜伏
・排出
ウイルス侵入 (英: viral entry) は、ウイルスが宿主細胞と接触し、ウイルス物質を細胞内に導入する、ウイルスのライフサイクルにおける感染の最も初期の段階である。ウイルス侵入に関与する主要なステップを以下に示す[1]。ウイルス間での違いにもかかわらず、ウイルス侵入に関するいくつかの共通した一般性がある。
細胞への近接
[編集]ウイルスが細胞に侵入する方法は、ウイルスの種類によって異なる。裸のカプシドを持つウイルスは、宿主細胞にある付着因子(英: attachment factor)に付着し、宿主細胞の膜に穴を開けてウイルスゲノムを挿入することで細胞内に侵入する。
ウイルスがエンベロープ型ウイルス (英: enveloped virus) の場合、ウイルスの侵入はより複雑になる。エンベロープ型ウイルスの場合、ウイルスは宿主細胞の表面にある付着因子に付着し、その後、融合現象が起こる。融合現象とは、ウイルス膜と宿主細胞膜が融合してウイルスが侵入することである。ウイルスは、ウイルスが結合できる受容体を保持している細胞である感受性細胞 (英: susceptible cell) に付着 (英: attachment) - または吸着 (英: adsorption) することでこれを行う。ウイルスエンベロープ(ウイルス外被)上の受容体は、細胞膜上の相補的な受容体と効果的に結合する。この結合により、2つの膜は相互に近接した状態を保ち、表面タンパク質間のさらなる相互作用を促進する。これは、細胞が感染する前に満たさなければならない最初の要件でもある。この必要条件が満たされると、細胞は感染しやすくなる、または感受性になる。この挙動を示すウイルスには、HIVや単純ヘルペスウイルスのような多くのエンベロープ型ウイルスが含まれている。
この基本的な考え方は、エンベロープを持たないウイルスにも当てはまる。よく研究されている例は、バクテリオファージ (または単にファージ) として知られる細菌に感染するウイルスがある。典型的なファージは、細菌表面の受容体に付着するために使用される長い尾を持っている。
概要
[編集]ウイルスが侵入する前に、ウイルスは宿主細胞に付着する必要がある。ウイルスのカプシドやウイルスエンベロープ上の特定のタンパク質が、標的細胞の細胞膜上の受容体タンパク質と呼ばれる特定のタンパク質に結合することで付着が達成される。ウイルスは、細胞の外界に対する自然な障壁であるリン脂質二重層で覆われている細胞に侵入する必要がある。この障壁が破られるプロセスは、ウイルスによって異なる。侵入のタイプは以下の通りである。
- 膜融合 (英: membrane fusion) または半融合状態 (英: hemifusion state): 細胞膜は穿孔され、展開したウイルスエンベロープとさらに結合させる。
- エンドサイトーシス (英: endocytosis): 宿主細胞はエンドサイトーシスの過程を経てウイルス粒子を取り込み、本質的に食品粒子のようにウイルスを飲み込む。
- ウイルス浸透 (英: viral penetration): ウイルスのカプシドまたはゲノムが宿主細胞の細胞質に注入される。
緑色蛍光タンパク質 (英: green fluorescent protein, GFP) を使用することで、ウイルスの侵入と感染をリアルタイムで可視化することができる。ウイルスが細胞内に侵入すると、複製はすぐには行われず、実際には時間がかかる (数秒から数時間)[2][3]。
膜融合による侵入
[編集]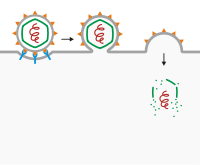
最もよく知られた例は、膜融合によるものである。ウイルスエンベロープを有するウイルスでは、ウイルス受容体が細胞表面の受容体に付着し、膜の穿刺または宿主細胞との融合を開始するために二次受容体が存在する場合がある。付着に続き、ウイルスエンベロープは宿主細胞の細胞膜と融合し、ウイルスが侵入する。このようにして細胞内に侵入するウイルスには、HIV, KSHV[4][5][6][7], 単純ヘルペスウイルス[8]などがある。
エンドサイトーシスによる侵入
[編集]
ウイルスエンベロープを持たないウイルスは、エンドサイトーシスを経て細胞内に侵入し、細胞膜を通して宿主細胞に摂取される。細胞は細胞外の環境から資源を取り込むことができ、ウイルスはこの仕組みを利用して通常の資源と同じように細胞内に入る。細胞内に入ると、ウイルスは細胞質にアクセスするために取り込まれた小胞を離れる。例としては、ポリオウイルス・C型肝炎ウイルス[9]・口蹄疫ウイルス[10]などがある。
SARS-CoV-2などの多くのエンベロープ型ウイルスも、エンドサイトーシスを介して細胞内に侵入する。エンドソームを介した細胞内への侵入は、ウイルスのカプシドを開いて内部の遺伝物質を放出するために必要な低pHとプロテアーゼへの暴露が保証される。さらに、エンドソームは、ウイルスを細胞内で輸送し、ウイルスの痕跡が表面に残らないようにする。これは免疫認識の基質となる可能性がある[11]。
遺伝子注入による侵入
[編集]第三のより具体的な例は、細胞上の受容体を介して細胞の表面に付着し、そのゲノムのみを細胞内に注入し、ウイルスの残りの部分を表面に残すことである。これは、細胞の感染に遺伝子のみが必要とされるウイルスに限定され (すぐに翻訳できるため、ほとんどのポジティブセンス一本鎖RNAウイルス)、さらに実際にこの動作を示すウイルスに限定される。最もよく研究されている例としてバクテリオファージが挙げられる。たとえば、T2ファージの尾部繊維が細胞に着地すると、その中央鞘が細胞膜を貫通し、ファージは頭部カプシドから細胞内にDNAを直接注入する[12]。
侵入直後の時期
[編集]ウイルスが細胞内に入ると、ウイルスはタンパク質の形成を活性化し (それ自身で、あるいは宿主を利用する)、可能であれば、宿主細胞を完全に制御する。制御機構には、細胞内防御の抑制、細胞シグナル伝達の抑制、および宿主細胞の転写と翻訳の抑制などがある。多くの場合、ウイルスに感染した細胞が死と衰退につながるのはこれらの細胞毒性作用である。
ウイルスが細胞内に侵入できる場合、その細胞はウイルスに感染しやすいと区分される。ウイルス粒子の導入後、ウイルス感染の次の段階であるウイルス複製の準備として、内容物 (ウイルス外被内のウイルスタンパク質と、何らかの形の核酸を介したウイルスゲノム) の展開が行われる。
脚注
[編集]- ^ Subramanian RP, Geraghty RJ (20 February 2007). “Herpes simplex virus type 1 mediates fusion through a hemifusion intermediate by sequential activity of glycoproteins D, H, L, and B”. Proceedings of the National Academy of Sciences, USA 104 (8): 2903–08. Bibcode: 2007PNAS..104.2903S. doi:10.1073/pnas.0608374104. PMC 1815279. PMID 17299053.
- ^ Lakadamyali, Melike; Michael J. Rust; Hazen P. Babcock; Xiaowei Zhuang (2003). “Visualizing infection of individual influenza viruses”. Proceedings of the National Academy of Sciences of the United States of America 100 (16): 9280–85. Bibcode: 2003PNAS..100.9280L. doi:10.1073/pnas.0832269100. PMC 170909. PMID 12883000.
- ^ Joo, K-I; P Wang (2008-05-15). “Visualization of Targeted Transduction by Engineered Lentiviral Vectors”. Gene Ther 15 (20): 1384–96. doi:10.1038/gt.2008.87. ISSN 0969-7128. PMC 2575058. PMID 18480844.
- ^ Kumar, Binod; Chandran, Bala (November 14, 2016). “KSHV Entry and Trafficking in Target Cells-Hijacking of Cell Signal Pathways, Actin and Membrane Dynamics”. Viruses 8 (11): 305. doi:10.3390/v8110305. ISSN 1999-4915. PMC 5127019. PMID 27854239.
- ^ Kumar, Binod; Dutta, Dipanjan; Iqbal, Jawed; Ansari, Mairaj Ahmed; Roy, Arunava; Chikoti, Leela; Pisano, Gina; Veettil, Mohanan Valiya et al. (October 2016). “ESCRT-I Protein Tsg101 Plays a Role in the Post-macropinocytic Trafficking and Infection of Endothelial Cells by Kaposi's Sarcoma-Associated Herpesvirus”. PLOS Pathogens 12 (10): e1005960. doi:10.1371/journal.ppat.1005960. ISSN 1553-7374. PMC 5072609. PMID 27764233.
- ^ Veettil, Mohanan Valiya; Kumar, Binod; Ansari, Mairaj Ahmed; Dutta, Dipanjan; Iqbal, Jawed; Gjyshi, Olsi; Bottero, Virginie; Chandran, Bala (April 2016). “ESCRT-0 Component Hrs Promotes Macropinocytosis of Kaposi's Sarcoma-Associated Herpesvirus in Human Dermal Microvascular Endothelial Cells”. Journal of Virology 90 (8): 3860–72. doi:10.1128/JVI.02704-15. ISSN 1098-5514. PMC 4810545. PMID 26819309.
- ^ Khanna, Madhu; Sharma, Sachin; Kumar, Binod; Rajput, Roopali (2014). “Protective Immunity Based on the Conserved Hemagglutinin Stalk Domain and Its Prospects for Universal Influenza Vaccine Development” (英語). BioMed Research International 2014: 546274. doi:10.1155/2014/546274. ISSN 2314-6133. PMC 4055638. PMID 24982895.
- ^ Campadelli-Fiume G, Amasio M, Avitabile E, Cerretani A, Forghieri C, Gianni T, Menotti L. "The multipartite system that mediates entry of herpes simplex virus into the cell." Rev Med Virol. 2007 Sep–Oct;17(5):313–26. Review.
- ^ Helle F, Dubuisson J. "Hepatitis C virus entry into host cells." Cell Mol Life Sci. 2007 Oct 4
- ^ N.J. Dimmock et al. Introduction to Modern Virology, 6th edition." Blackwell Publishing, 2007.[要ISBN][要ページ番号]
- ^ Howley, Peter M; Knipe, David M Fields Virology[要ページ番号] Lippincott Williams & Williams 2013[要ISBN]
- ^ Sebestyén MG, Budker VG, Budker T, Subbotin VM, Zhang G, Monahan SD, Lewis DL, Wong SC, Hagstrom JE, Wolff JA. "Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules." J Gene Med. 2006 Jul;8(7):852–73.
