コネクソン
| コネクソン Connexon | |
|---|---|
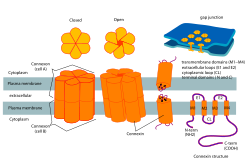 コネクソンとコネクシンの構造 | |
| 概要 | |
| ラテン語 | connexona |
| TH | H1.00.01.1.02025 |
| 解剖学用語 | |
コネクソン(Connexon)は、コネキシンと呼ばれるタンパク質が6つ集合した複合体で、2つの隣接した細胞の細胞質同士をつなぐギャップ結合の孔を形成する。コネキシンヘミチャネル(connexin hemichannel)とも呼ばれる。このチャネルはイオンやシグナル伝達分子の双方向性の移動を可能にする[1]。
ギャップ結合を形成している細胞の間では、両側の細胞からヘミチャネル(半チャネル)が提供され、これら2つのコネクソンが対となって結合することで完全な細胞間ギャップ結合チャネルが形成される。しかしいくつかの細胞では、ヘミチャネル自体が細胞質と細胞外をつなぐ導管としての活性を持ち、イオンや 1–2 kDa以下の低分子を移動させる。コネクソンのこの機能については細胞内のシグナル伝達に重要な役割を果たすことを示唆する証拠が得られているものの、それ以外はほとんど未解明である[2]。
コネクソンが同じタイプのコネキシンから構成されている場合はホモマー(homomer)、異なるタイプのコネキシンから構成されている場合はヘテロマー(heteromer)と呼ばれる[3]。
構造
[編集]コネクソンはギャップ結合の形成に寄与し、神経回路の電気シナプスの必須の構成要素である[4]。コネクソンはコネキシンから構成されるヘミチャネルである。コネキシンは構造的には4つのαヘリックスからなる膜貫通ドメインから構成され、それらは2つの細胞外ループと1つの細胞質ループで連結されている。N末端とC末端はともに細胞内に存在する。コネキシンのタイプは予測分子量によって区別されている(コネキシン43(Cx43)は 43 kDaである)。コネクソンは隣接する他の細胞の細胞膜に位置するヘミチャネルへドッキングすることでギャップ結合を形成する[2]。この過程によって、双方の細胞の細胞膜を貫通する細胞間チャネルが形成される。
コネクソンの組み立ては、細胞内でのコネキシンの合成で始まり、細胞膜でのギャップ結合プラークの形成で終わる。コネクソンを構成するコネキシンサブユニットタンパク質は小胞体膜で合成される。これらのサブユニットはゴルジ体でコネクソンへとオリゴマー化する[4]。その後、コネクソンは細胞膜の適切な部位へ送られる。コネクソンは隣接する細胞の適合するコネクソンと結合し、ギャップ結合プラークを形成する[4]。この過程の大部分はさまざまな酵素によるリン酸化によって媒介され、特定のタンパク質との相互作用が行われたり防がれたりする[4]。
コネクソン構造は細胞膜から除去されて分解される。コネクソンはヘミチャネルどうしがドッキングしているため、二重膜のチャネル構造として細胞内へ取り込まれる[4]。この過程はインターナリゼーション(internalization)またはエンドサイトーシスと呼ばれる。ギャップ結合は一般的に複数の方法で取り込まれる可能性が研究からは示唆されているが、最もよく知られ、よく研究されているのはクラスリンを介したエンドサイトーシスである。この過程では、膜の一部がクラスリンに包まれ、細胞の内側に向けて出芽して小胞を形成し、リソソーム経路で分解される[4]。ユビキチン化による細胞内のシグナル伝達も分解に関与している[4]。
細胞機能
[編集]性質
[編集]個々のコネキシンタンパク質の性質がコネクソンチャネル全体の性質を決定する。チャネルの透過性と選択性は、チャネルの径だけでなく、電荷の選択性などコネキシンの分子的な選択性によっても決定される[2]。コネクソンは、可溶性のセカンドメッセンジャー、アミノ酸、ヌクレオチド、イオン、グルコースの透過性が特に高いことが研究からは示されている[2]。また、チャネルは電位感受性である。コネクソンチャネルは電位依存的なゲートとなり、2つの細胞の間の電位差に依存して開いたり閉じたりする[2]。ゲートは、細胞内外の電位差(膜電位)に依存した電位感受性も示す[2]。
調節
[編集]ギャップ結合間のコミュニケーションは多くの方法で調節されている。主要な調節機構としては次のようなものがある。
- 化学的調節 – 化学的な調節の一般的なタイプの1つは、コネキシンの特定のドメインとカルシウムイオン(Ca2+)との相互作用による調節である。完全には解明されていないものの、この相互作用によってCa2+はチャネルの孔をブロックする。他のものとしては、酸性化(細胞内のpHの低下)に対するチャネルの応答がある。細胞内の酸性化はコネキシンのC末端ドメインの変化を引き起こし、チャネルの活性を低下させることが判明している[2]。
- タンパク質のリン酸化 – タンパク質のリン酸化は、ゴルジ体からのコネキシンの輸送、特定の領域へのコネクソンの蓄積、不必要なチャネルの分解など、複数の方法で細胞間のコミュニケーションを調節する。これらの作用は非常に複雑なものであるが、タンパク質のリン酸化が関与していることは知られている[2]。
- 体液性因子による調節 – ギャップ結合のコミュニケーションの体液性因子による調節は、神経伝達物質、成長因子、さまざまな生理活性化合物によって行われる。アドレナリンやノルアドレナリンなどの神経伝達物質は神経細胞のギャップ結合に作用し、神経細胞に沿った活動電位の伝播を引き起こす。このタイプの調節が行われるギャップ結合は、心臓組織の神経細胞や脊椎動物の網膜に存在する[2]。
生理学的機能
[編集]コネクソンは行動と神経生理に重要な役割を果たしている。研究は近年始まったばかりであり、その病理学的な機能に関する詳細の多くは未解明である。中枢神経系では、コネクソンはてんかん、虚血、炎症、神経変性などの疾患で大きな役割を果たしている[1]。これらの疾患においてコネクソンがどのような役割を果たすのかに関する分子的機構は完全には理解されておらず、さらなる研究が進行中である。中枢神経系での重要な役割に加えて、コネクソンは心臓組織の機能にも重要である。コネクソンを介した直接的な連結によって迅速で協調的に神経細胞の発火を行うことで、心臓は特定の刺激に応答して素早く拍動したり心拍数を変えたりすることが可能となる[2]。また、コネクソンは細胞の発達にも重要な役割を果たす。具体的には、脳の発達や特定の疾患・病理時の脳の修復に関与し、細胞分裂と細胞増殖を助ける神経発生の役割を担っている。これらの過程においてコネクソンが補助を行う機構はまだ研究途上であるが、プリン作動性シグナル伝達(アデノシンやATPなどのプリンヌクレオシドやヌクレオチドによって媒介される細胞外シグナル伝達の1種)とATPに対する透過性が関与する機構であることが現在知られている[1]。他の重要な役割は、グルコースの検知とシグナル伝達である。コネクソンは、摂食行動や睡眠-覚醒サイクル、エネルギー利用に影響を与える細胞外グルコース濃度の変化を引き起こす[1]。さらに、高ストレスや炎症時にコネクソンを介したグルコースの取り込みが増加することが示されている(その機構は完全には理解されていない)[1]。
関連する疾患
[編集]心血管疾患や糖尿病の一部はコネクソンと関係しており、グルコースの取り込みのためのインスリン産生不全が引き起こされたり、コネキシンと呼ばれるコネクソンのユニットの分解が心血管疾患の発症へつながったりしていると考えられている。心血管疾患と糖尿病では、心臓と膵臓の細胞内の類似した部位が影響を受けている。その部位とはギャップ結合であり、そこでコネクソンは電気的な伝達によって迅速な細胞間相互作用を促進している。ギャップ結合は多くの場合心筋などの神経末端部に存在し、肝臓での恒常性維持や腎臓の適切な機能にも重要である。ギャップ結合自身は、コネクソンヘミチャネルによって形成される特殊な膜貫通タンパク質構造である[5]。心血管疾患と糖尿病は、それぞれギャップ結合を構成している主要なコネキシンと関係している。
心血管疾患に関しては、コネキシン43(Cx43)が心臓の同期した拍動を促進する介在板のギャップ結合で一般的なコネクソンのサブユニットである。心血管疾患を発症した場合、Cx43サブユニットは酸化ストレスの徴候を示し始め、これは加齢や血管機能を低下させる食生活に伴う有害な毒素の蓄積に対する心臓の対抗機能である[5]。さらに、心筋梗塞後の心室リモデリングや創傷治癒に関与するCx43の発現の低下が構造的心疾患ではみられる[6]。一方で、心臓におけるCx43の具体的機構はあまり理解されていない[6]。こうしたCx43の発現の変化や酸化ストレスは、心拍の協調性の異常につながり、不整脈の素因となる可能性がある[5]。
コネクソンは、I型糖尿病とII型糖尿病の双方と関係している。コネキシン36(Cx36)サブユニットは、肝臓と膵臓のギャップ結合でインスリンの排出とグルコース誘導性インスリン放出(glucose-induced insulin release)を媒介する[3]。肝臓と膵臓の恒常性は、内分泌シグナル伝達と呼ばれる細胞間相互作用の複雑なシステムによって支えられている。ホルモンの血流への分泌は離れた器官の標的化に利用される。一方、膵臓と肝臓の内分泌シグナルは、シグナル伝達経路、イオンチャネル、Gタンパク質共役型受容体、受容体型チロシンキナーゼ、細胞間接触を介して細胞膜から短距離で作用する[3]。これらの組織のギャップ結合は、隣接する細胞同士を緊密に接続することで、細胞間やより大きな器官間での細胞内のシグナルを仲介する。ギャップ結合での緊密な接続により、組織内の細胞はより効率的にコミュニケーションし、恒常性を維持することが可能となる。ギャップ結合の目的は、イオン、栄養素、代謝産物、セカンドメッセンジャー、低分子量生体分子の通路の調節である[3]。糖尿病では、Cx36の喪失や分解によって、膵臓でのインスリン産生と肝臓でのグルコースの取り込みが大きく阻害される。これらの組織でのCx36の欠乏はギャップ結合の能力に悪影響を与え、機能の低下や疾患へとつながる可能性がある。ギャップ結合の喪失や分解と関係した類似の症状はII型糖尿病でも観察されているが、ヒトのI型、II型糖尿病におけるCx36の機能は未解明である。Cx36はGJD2遺伝子によってコードされているが、II型糖尿病や糖尿病性症候群の遺伝的素因となる遺伝子座である[3]。
出典
[編集]- ^ a b c d e Cheung, Giselle; Chever, Oana; Rouach, Nathalie (2014-11-04). “Connexons and Pannexons: Newcomers in Neurophysiology”. Frontiers in Cellular Neuroscience 8: 348. doi:10.3389/fncel.2014.00348. PMC 4219455. PMID 25408635.
- ^ a b c d e f g h i j Herve, Jean-Claude; Derangeon, Mickael (2012-09-01). “Gap-junction-mediated cell-to-cell communication”. Cell and Tissue Research 352 (1): 21–31. doi:10.1007/s00441-012-1485-6. PMID 22940728.
- ^ a b c d e Wright, Josephine; Richards, Toby; Becker, David (2012-03-01). “Connexins And Diabetes”. Cardiology Research and Practice 2012: 496904. doi:10.1155/2012/496904. PMC 3303578. PMID 22536530.
- ^ a b c d e f g Thevenin, Anastasia F (2013-03-07). “Proteins and Mechanisms Regulating Gap-Junction Assembly, Internalization, and Degradation”. Physiology 28 (2): 93–116. doi:10.1152/physiol.00038.2012. PMC 3768091. PMID 23455769.
- ^ a b c Tomaselli, Gordon F. (2010-12-04). “Oxidant stress derails the cardiac connexon connection”. Journal of Clinical Investigation 120 (1): 87–89. doi:10.1172/jci41780. PMC 2798705. PMID 20038808.
- ^ a b Zhang, Yan; Wang, Hongtao; Kovacs, Attila; Kanter, Evelyn; Yamada, Kathryn (2010-02-01). “Reduced expression of Cx43 attenuates ventricular remodeling after myocardial infarction via impaired TGF-β signaling”. American Journal of Physiology. Heart and Circulatory Physiology 298 (2): H477-87. doi:10.1152/ajpheart.00806.2009. PMC 2822575. PMID 19966054.
関連文献
[編集]- Andrew L Harris and Darren Locke (2009). Connexins, A Guide. New York: Springer. pp. 574. ISBN 978-1-934115-46-6