ダントロレン
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 70% |
| 代謝 | 肝臓 |
| 排泄 | 腎臓 |
| 識別 | |
| CAS番号 | 7261-97-4 |
| ATCコード | M03CA01 (WHO) |
| PubChem | CID: 2952 |
| DrugBank | APRD00901 |
| ChemSpider | 2847 |
| 化学的データ | |
| 化学式 | C14H10N4O5 |
| 分子量 | 314.253 g/mol |
| |
ダントロレン(Dantrolene)とは筋弛緩薬の一つである。リアノジン受容体を遮断[1]して横行小管から筋小胞体への興奮の伝達過程を遮断することにより筋小胞体からのCa2+の遊離を抑制し、筋弛緩を引き起こす[2]。商品名ダントリウム。
全身麻酔で稀に引き起こされる悪性高熱症の治療の第一選択薬である。悪性症候群、筋痙縮(脳梗塞後、対麻痺、脳性麻痺、多発性硬化症)、2,4-ジニトロフェノール毒性の治療にも用いられる[3]。
日本ではオーファンパシフィック社が製造販売している。経口薬と注射剤があるが、2023年11月現在、経口剤「ダントリウムカプセル25mg」の薬価が1カプセル18.9円[4]なのに対し、注射薬「ダントリウム静注用20mg」の薬価は一瓶9039円[5]と高価であり、常備している病院が少ないという問題を抱えている。
悪性高熱症に備えて病院には720mg(体重70kgの患者を想定)のダントロレンを備蓄すべきだとする意見がある[6]。2023年現在だと、上記の20mgが36瓶分、薬価は合計で325,404円となる。
適応症
[編集]- 右記の疾患に伴う痙性麻痺(内服): 脳血管障害後遺症、脳性麻痺(CP)、外傷後遺症(頭部外傷、脊髄損傷など)、頸部脊椎症、後縦靱帯骨化症、脊髄小脳変性症(多系統萎縮症)、痙性脊髄麻痺、脊髄炎、脊髄症、筋萎縮性側索硬化症(ALS)、多発性硬化症(MS)、スモン(SMON)、潜水病
- 全身こむら返り病(内服)
- 悪性症候群(内服・静注用)
- 麻酔時における悪性高熱症(静注用)
禁忌
[編集]経口薬のみ禁忌が設定されている[7]。注射薬にはない[8]。
- 閉塞性肺疾患あるいは心疾患による著しい心肺機能低下の見られる患者
- 筋無力症状のある患者
- 肝疾患のある患者
- 製剤成分に対し過敏症の既往歴のある患者
注射薬の用途は主に救命であり、禁忌を回避して患者が落命する事のない様にこれらの項目は『慎重投与』に設定されている[9]:23。ただし、当然ながら、過敏症状の出た患者に使用できない。
妊産婦・授乳婦
[編集]妊婦に使用した場合の安全性は確立していないので、治療の有益性が危険性を上回る場合にのみ使用すべきである。分娩直前の妊婦に使用して児に筋緊張低下が見られた事がある[3]。
ダントロレンは母乳中に移行するので[7][8]、授乳を避けるかダントロレンを中止する必要がある。
副作用
[編集]経口薬、注射薬に共通の重大な副作用に呼吸不全(0.1〜5%未満)、ショック(0.1〜5%未満)、アナフィラキシー(0.1〜5%未満)、イレウス(0.1〜5%未満)があるほか、経口薬の重大な副作用として黄疸(0.1%未満)、肝障害、PIE症候群、胸膜炎がある[7][8]。
中枢神経系の副作用が特に多く、構音障害、視覚障害、抑うつ、混乱、幻覚、頭痛、不眠、痙攣の増悪・頻発、緊張増加が挙げられる。より頻度の低い副作用には、呼吸抑制、呼吸苦がある。自動車の運転や機械の操作に差し障る程の鎮静を起こす。
消化器系の副作用として、異味、食欲不振、嘔気、嘔吐、腹部痙攣、下痢が起こる。
肝臓に関しては、非症候性の肝酵素および/またはビリルビン上昇、そしてより重篤な致死性/非致死性肝炎が挙げられる。肝炎の危険性は、ダントロレン投与期間と投与量に依存的である。悪性高熱症に短期間使用した場合の肝毒性は観察されていない。
心膜炎を伴う胸水(経口薬のみ)や、稀に骨髄抑制、広範囲の筋痛、背部痛、皮膚の異常、一過性の心血管異常、結晶尿が見られることがある。治療後数日間、筋力低下が生じる。
発癌性・変異原性
[編集]30ヶ月間長期癌原性試験(ラット)および18ヶ月間慢性毒性試験(ラット)でダントロレンの発癌性が示唆されたが、24ヶ月間長期癌原性試験(マウス)では所見は見られなかった[7][8]。
細菌を用いた復帰突然変異試験(エイムス試験)および哺乳類培養細胞を用いた染色体異常試験の結果は陽性であった[7][8]。
ヒトでのこれらの臨床経験は報告されていない。
作用機序
[編集]ダントロレンは骨格筋のリアノジン受容体に結合して興奮収縮連関を抑制し、細胞内遊離カルシウム濃度を低下させる[3]。
化学的特徴
[編集]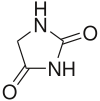

化学的には、ダントロレンはヒダントイン誘導体に属するが、同じヒダントイン誘導体であるフェニトインの様な抗てんかん効果は見られない[3]。
ダントロレンの水への溶解度は低いので使い難い面がある[3][10]。21世紀初頭にはダントロレンの水溶性類縁物質であるアズモレンがダントロレンと同じ効能・効果の取得を目指して開発されていた[10]。アズモレンはニトロ基の代わりにブロモ基を持ち、水溶性が30倍高くなっている[3]。
薬物相互作用
[編集]- ジルチアゼム・ベラパミル型カルシウム拮抗剤:ダントロレンとこれらのカルシウム拮抗薬と併用すると、循環虚脱、不整脈、心筋抑制、高カリウム血症を来たす。
- ベクロニウム等の非脱分極性神経筋遮断薬:神経筋遮断効果が増強される。
- 中枢神経系抑制薬:鎮静効果が増強される。ベンゾジアゼピンを併用すると筋が脱力する。
- 経口避妊薬およびエストロゲン補充療法:ダントロレンの肝毒性が増幅される。(特に35歳以上の場合。)
開発の経緯
[編集]ダントロレンが最初に学術文献に登場したのは1967年で、いくつかのヒダントイン誘導体が新規筋弛緩薬として提案されたものの一つであった[12]。その後広く研究される様になり、骨格筋への作用の詳細が報告されたのが1973年であった[13]。
ダントロレンは1975年に悪性高熱症への有効性が明らかとされる[14]以前から痙縮の治療に多く使用されていた[15]。遺伝的に悪性高熱症を発症し易いブタを用いてハロタンで実験的に発症させた場合、ダントロレンを点滴静脈注射した際の救命率は87.5%(7/8)であった。後にヒトを対象とした大規模多施設臨床試験が実施され、1982年に結果が公表されて有効性が確かめられた[16]。有効性は1993年には疫学的にも確認された[17]。ダントロレンを使い始める前は、悪性高熱症に有効な薬剤はプロカインのみであり、その有効性は動物実験では6割に過ぎなかった[14]。
出典
[編集]- ^ Zucchi, R; Ronca-Testoni, S (March 1997). “The sarcoplasmic reticulum Ca2+ channel/ryanodine receptor: modulation by endogenous effectors, drugs and disease states.”. Pharmacological reviews 49 (1): 1-51. PMID 9085308.
- ^ 伊藤勝昭他『新獣医薬理学 第二版』近代出版、2004年。ISBN 4874021018。
- ^ a b c d e f Krause T, Gerbershagen MU, Fiege M, Weisshorn R, Wappler F (2004). “Dantrolene – a review of its pharmacology, therapeutic use and new developments”. Anaesthesia 59 (4): 364–73. doi:10.1111/j.1365-2044.2004.03658.x. PMID 15023108.
- ^ ダントロレンナトリウム水和物カプセル、KEGG DRUG データベース
- ^ ダントロレンナトリウム水和物、KEGG DRUG データベース
- ^ Yeung EYH, Munroe J (2015). “Development of a malignant hyperthermia protocol”. BMC Proceedings 9 (Suppl1): A32. doi:10.1186/1753-6561-9-S1-A32. PMC 4306034.
- ^ a b c d e “ダントリウムカプセル25mg 添付文書” (2015年10月). 2016年5月2日閲覧。
- ^ a b c d e “ダントリウム静注用20mg 添付文書” (2015年10月). 2016年5月2日閲覧。
- ^ “ダントリウム静注用20mg インタビューフォーム” (PDF). オーファンパシフィック (2015年10月). 2016年5月2日閲覧。
- ^ a b Sudo RT, Carmo PL, Trachez MM, Zapata-Sudo G (March 2008). “Effects of azumolene on normal and malignant hyperthermia-susceptible skeletal muscle”. Basic Clin Pharmacol Toxicol 102 (3): 308–16. doi:10.1111/j.1742-7843.2007.00156.x. PMID 18047479.
- ^ “Dantrolene Drug Interactions”. Epocrates Online. Epocrates (2008年). 2008年12月31日閲覧。
- ^ Snyder HR, Davis CS, Bickerton RK, Halliday RP (September 1967). “1-[(5-arylfurfurylidene)amino]hydantoins. A new class of muscle relaxants”. J Med Chem 10 (5): 807–10. doi:10.1021/jm00317a011. PMID 6048486.
- ^ Ellis KO, Castellion AW, Honkomp LJ, Wessels FL, Carpenter JE, Halliday RP (June 1973). “Dantrolene, a direct acting skeletal muscle relaxant”. J Pharm Sci 62 (6): 948–51. doi:10.1002/jps.2600620619. PMID 4712630.
- ^ a b Harrison GG (January 1975). “Control of the malignant hyperpyrexic syndrome in MHS swine by dantrolene sodium”. Br J Anaesth 47 (1): 62–5. doi:10.1093/bja/47.1.62. PMID 1148076. A reprint of the article, which became a "Citation Classic", is available in Br J Anaesth 81 (4): 626–9. PMID 9924249 (free full text).
- ^ Pinder, RM; Brogden, RN; Speight, TM; Avery, GS (January 1977). “Dantrolene sodium: a review of its pharmacological properties and therapeutic efficacy in spasticity.”. Drugs 13 (1): 3–23. doi:10.2165/00003495-197713010-00002. PMID 318989.
- ^ Kolb ME, Horne ML, Martz R (April 1982). “Dantrolene in human malignant hyperthermia”. Anesthesiology 56 (4): 254–62. doi:10.1097/00000542-198204000-00005. PMID 7039419.
- ^ Strazis KP, Fox AW (March 1993). “Malignant hyperthermia: review of published cases”. Anesth Analg 77 (3): 297–304. doi:10.1213/00000539-199377020-00014.
関連項目
[編集]外部リンク
[編集]- http://www.kompendium.ch/MonographieTxt.aspx?lang=de&MonType=fi[リンク切れ] Swiss Drug Compendium on oral Dantrolene