ブロモドメイン
| Bromodomain | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
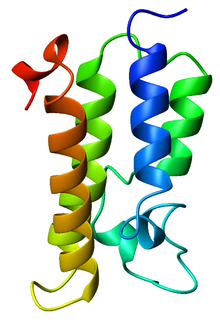 出芽酵母GCN5のブロモドメインのリボン図[1] | |||||||||||
| 識別子 | |||||||||||
| 略号 | Bromodomain | ||||||||||
| Pfam | PF00439 | ||||||||||
| InterPro | IPR001487 | ||||||||||
| SMART | SM00297 | ||||||||||
| PROSITE | PDOC00550 | ||||||||||
| SCOP | 1b91 | ||||||||||
| SUPERFAMILY | 1b91 | ||||||||||
| CDD | cd04369 | ||||||||||
| |||||||||||
ブロモドメイン(英: bromodomain)は、アセチル化されたリジン残基を認識する、約110アミノ酸からなるタンパク質ドメインである。アセチル化リジンはヒストンのN末端テールなどに存在する。ブロモドメインはリジンのアセチル化の「リーダー」(reader)であり、アセチル化リジンが持つシグナルの伝達と、さまざまな正常・異常な表現型への変換を担う[2]。ブロモドメインのアセチル化リジンに対する親和性は、複数のアセチル化部位が近接して存在する領域でより高くなる。こうした認識はタンパク質-ヒストン間の結合やクロマチンリモデリングの必要条件となっていることが多い。このドメインは全てαヘリックスからなる4ヘリックスバンドル構造をとり、ヘリックス間のさまざまな長さのループによってアセチル化リジンを認識する疎水的ポケットが形成される[1][3]。
発見
[編集]ブロモドメインはJohn W. Tamkunらによって、ショウジョウバエの遺伝子Brahma/brmの研究から新規構造モチーフとして同定され、転写活性化に関与する遺伝子との配列類似性が示された[4]。ブロモドメインの名称はBrahmaとの関係に由来するものであり、臭素(bromine)とは無関係である。
ブロモドメインを持つタンパク質
[編集]ブロモドメインを持つタンパク質は、ヒストンアセチルトランスフェラーゼ活性、クロマチンリモデリング、転写の媒介やコアクチベーターなど幅広い機能を持つ。2015年時点で43種類のタンパク質がブロモドメインを持つことが知られており、そのうち11種類はブロモドメインを2個持ち、1種類には6個のブロモドメインが存在する[2]。ブロモドメインを持つタンパク質の調製、生化学的解析、構造決定による詳細な記載がなされている[5]。
BETファミリー
[編集]ブロモドメインファミリーの良く知られた例として、BET(bromodomain and extraterminal domain)ファミリーが挙げられる。このファミリーには、BRD2、BRD3、BRD4、BRDTが含まれる[6]。
その他
[編集]ASH1Lなどのタンパク質もブロモドメインを持つ。ブロモドメインを持つタンパク質の機能不全は、扁平上皮癌やその他のがんと関連している[7]。EP300やPCAFなどのヒストンアセチルトランスフェラーゼも、アセチルトランスフェラーゼドメインに加えてブロモドメインを持つ[8][9][10]。
ヒトの疾患における役割
[編集]ブロモドメインに対する低分子阻害剤の開発により、ブロモドメインが細胞内のアセチル化状態の異常を疾患表現型へ変換する役割を担っていることが明らかにされた。この発見により、ブロモドメイン含有タンパク質ががんの生物学や炎症、再ミエリン化などの過程に重要な役割を果たしていることが浮き彫りとなった[2]。
BETファミリーのメンバーは、がん[11][12]や多発性硬化症[13]の治療標的として示唆されている。BET阻害剤はがんの複数の前臨床モデルで治療効果が示されており、現在臨床試験が行われている[14]。多発性硬化症への応用はまだ前臨床段階である。
非BET型ブロモドメインタンパク質であるBRD7やBRD9に対する低分子阻害剤も開発されている[15][16]。
出典
[編集]- ^ a b PDB: 1e6i; “The structural basis for the recognition of acetylated histone H4 by the bromodomain of histone acetyltransferase gcn5p”. EMBO J. 19 (22): 6141–9. (November 2000). doi:10.1093/emboj/19.22.6141. PMC 305837. PMID 11080160.
- ^ a b c Ntranos, Achilles; Casaccia, Patrizia (2016). “Bromodomains: Translating the words of lysine acetylation into myelin injury and repair”. Neuroscience Letters 625: 4–10. doi:10.1016/j.neulet.2015.10.015. PMC 4841751. PMID 26472704.
- ^ Zeng L, Zhou MM (February 2002). “Bromodomain: an acetyl-lysine binding domain”. FEBS Lett. 513 (1): 124–8. doi:10.1016/S0014-5793(01)03309-9. PMID 11911891.
- ^ “brahma: a regulator of Drosophila homeotic genes structurally related to the yeast transcriptional activator SNF2/SWI2”. Cell 68 (3): 561–72. (February 1992). doi:10.1016/0092-8674(92)90191-E. PMID 1346755.
- ^ Ren, C; Zeng, L; Zhou, MM (2016). “Preparation, Biochemical Analysis, and Structure Determination of the Bromodomain, an Acetyl-Lysine Binding Domain.”. Methods in Enzymology 573: 321–43. doi:10.1016/bs.mie.2016.01.018. ISBN 9780128053652. PMID 27372760.
- ^ Taniguchi, Yasushi (2016-11-07). “The Bromodomain and Extra-Terminal Domain (BET) Family: Functional Anatomy of BET Paralogous Proteins”. International Journal of Molecular Sciences 17 (11): 1849. doi:10.3390/ijms17111849. ISSN 1422-0067. PMC 5133849. PMID 27827996.
- ^ Filippakopoulos, Panagis (2012). “Histone Recognition and Large-Scale Structural Analysis of the Human Bromodomain Family”. Cell 149 (1): 214–231. doi:10.1016/j.cell.2012.02.013. PMC 3326523. PMID 22464331.
- ^ Dhalluin, C; Carlson, J. E.; Zeng, L; He, C; Aggarwal, A. K.; Zhou, M. M.; Zhou, Ming-Ming (1999). “Structure and ligand of a histone acetyltransferase bromodomain”. Nature 399 (6735): 491–6. doi:10.1038/20974. PMID 10365964.
- ^ Santillan, D. A.; Theisler, C. M.; Ryan, A. S.; Popovic, R; Stuart, T; Zhou, M. M.; Alkan, S; Zeleznik-Le, N. J. (2006). “Bromodomain and histone acetyltransferase domain specificities control mixed lineage leukemia phenotype”. Cancer Research 66 (20): 10032–9. doi:10.1158/0008-5472.CAN-06-2597. PMID 17047066.
- ^ Hay, D. A.; Fedorov, O; Martin, S; Singleton, D. C.; Tallant, C; Wells, C; Picaud, S; Philpott, M et al. (2014). “Discovery and optimization of small-molecule ligands for the CBP/p300 bromodomains”. Journal of the American Chemical Society 136 (26): 9308–19. doi:10.1021/ja412434f. PMC 4183655. PMID 24946055.
- ^ Jung, Marie; Gelato, Kathy A; Fernández-Montalván, Amaury; Siegel, Stephan; Haendler, Bernard (2015-06-16). “Targeting BET bromodomains for cancer treatment”. Epigenomics 7 (3): 487–501. doi:10.2217/epi.14.91. PMID 26077433.
- ^ Da Costa, D.; Agathanggelou, A.; Perry, T.; Weston, V.; Petermann, E.; Zlatanou, A.; Oldreive, C.; Wei, W. et al. (2013-07-19). “BET inhibition as a single or combined therapeutic approach in primary paediatric B-precursor acute lymphoblastic leukaemia” (英語). Blood Cancer Journal 3 (7): e126. doi:10.1038/bcj.2013.24. PMC 3730202. PMID 23872705.
- ^ Gacias, Mar; Gerona-Navarro, Guillermo; Plotnikov, Alexander N.; Zhang, Guangtao; Zeng, Lei; Kaur, Jasbir; Moy, Gregory; Rusinova, Elena et al. (2014). “Selective Chemical Modulation of Gene Transcription Favors Oligodendrocyte Lineage Progression”. Chemistry & Biology 21 (7): 841–854. doi:10.1016/j.chembiol.2014.05.009. ISSN 1074-5521. PMC 4104156. PMID 24954007.
- ^ Shi, Junwei (2014). “The Mechanisms behind the Therapeutic Activity of BET Bromodomain Inhibition”. Molecular Cell 54 (5): 728–736. doi:10.1016/j.molcel.2014.05.016. PMC 4236231. PMID 24905006.
- ^ Clark, P. G.; Vieira, L. C.; Tallant, C; Fedorov, O; Singleton, D. C.; Rogers, C. M.; Monteiro, O. P.; Bennett, J. M. et al. (2015). “LP99: Discovery and Synthesis of the First Selective BRD7/9 Bromodomain Inhibitor”. Angewandte Chemie International Edition 54 (21): 6217–21. doi:10.1002/anie.201501394. PMC 4449114. PMID 25864491.
- ^ Theodoulou, N. H.; Bamborough, P; Bannister, A. J.; Becher, I; Bit, R. A.; Che, K. H.; Chung, C. W.; Dittmann, A et al. (2015). “The Discovery of I-BRD9, a Selective Cell Active Chemical Probe for Bromodomain Containing Protein 9 Inhibition”. Journal of Medicinal Chemistry 59 (4): 1425–39. doi:10.1021/acs.jmedchem.5b00256. PMC 7354103. PMID 25856009.