二フッ化二酸素
| 二フッ化二酸素 | |
|---|---|
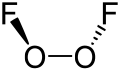
|

|
dioxygen difluoride | |
fluorooxy hypofluorite | |
別称 二酸化二フッ素 | |
| 識別情報 | |
| 略称 | FOOF |
| CAS登録番号 | 7783-44-0 |
| PubChem | 123257 |
| ChemSpider | 109870 |
| ChEBI | |
| Gmelin参照 | 1570 |
| |
| |
| 特性 | |
| 化学式 | O2F2 |
| モル質量 | 69.996 g mol−1 |
| 融点 |
-154 °C, 119 K, -245 °F |
| 沸点 |
-57 °C, 216 K, -71 °F (推定) |
| 他の溶媒への溶解度 | 分解 |
| 関連する物質 | |
| 関連物質 | 過酸化水素 二フッ化酸素 フッ化クロリル 二フッ化二硫黄 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
二フッ化二酸素(にフッかにさんそ、英: dioxygen difluoride)は、化学式が O2F2 と表される酸素のフッ化物である。オレンジ色の固体で、-163 °Cで溶けて赤色の液体となる[1]。強力な酸化剤で、-160 °C でさえ1日に4 %の割合で分解して二フッ化酸素と酸素を生じる[2]。
合成
[編集]二フッ化二酸素は、低圧 (7-17 mmHg) のフッ素ガスと酸素ガスの1:1混合物に、2.1-2.4 kVの電圧をかけて25-30 mAで放電をすることで得られる。これは、Otto Ruff によって1933年に初めて合成された際に使われた方法である[3]。もう1つの合成法は、O2 と F2 を-196 °Cに冷却したステンレススチール管の中で混合し、数時間3 MeVで制動放射する方法である。
構造
[編集]O2F2 中では、酸素は+1の非常に珍しい酸化数をとる。他の化合物中では、酸素は通常-2の酸化数をとる。
二フッ化二酸素の構造は、90度に近い二面角をもつ過酸化水素 H2O2 に類似している。この構造はVSEPR則による予測と一致している。O-O 結合長は、二酸素 O2 中の O=O 二重結合の長さ120.7 pmより1 pmだけ長い。

二フッ化二酸素中の結合は、特に非常に短い O-O 結合長と長い O-F 結合長のため、数年間に渡って相当な推論の対象であった。Bridgeman は、O-O “三重結合”および O-F 単結合は、フッ素原子上の孤立電子対と O-O π結合の反発によって不安定化し長くなる、という説を提案した[4]。フッ素の孤立電子対の反発は、フッ素分子の長く弱い共有結合の原因でもある。
反応性
[編集]二フッ化二酸素の包括的な性質は、すべての反応が-100 ℃付近で行われなければならないにもかかわらず激しく反応する、その酸化力にある[5]。BF3 や PF5 と反応させると、対応するジオキシゲニル塩を与える[2][6]。
また、ウラン酸化物やプルトニウム酸化物を対応する六フッ化物に変化させる[7]。
出典
[編集]- ^ Kirshenbaum, A. D.; Grosse, A. V. (1959), “Ozone Fluoride or Trioxygen Difluoride, O3F2”, Journal of the American Chemical Society 81 (6): 1277, doi:10.1021/ja01515a003
- ^ a b Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, Academic Press, ISBN 0-12-352651-5
- ^ Ruff, O.; Mensel, W. (1933). “Neue Sauerstofffluoride: O2F2 und OF”. Zeitschrift für anorganische und allgemeine Chemie 211 (1-2): 204-208. doi:10.1002/zaac.19332110122.
- ^ Bridgeman, A. J.; Rothery, J. (1999), “Bonding in mixed halogen and hydrogen peroxides”, Journal of the Chemical Society, Dalton Transactions 1999 (22): 4077-4082, doi:10.1039/a904968a
- ^ Streng, A. G. (1963), “The Chemical Properties of Dioxygen Difluoride”, Journal of the American Chemical Society 85 (10): 1380-1385, doi:10.1021/ja00893a004
- ^ Solomon, I. J.; et al. (1964), “New Dioxygenyl Compounds”, Inorganic Chemistry 3 (3): 457, doi:10.1021/ic50013a036
- ^ Atwood, D. A. (2006), “Fluorine: Inorganic Chemistry”, Encyclopedia of Inorganic Chemistry, John Wiley & Sons, doi:10.1002/0470862106.ia076
![{\displaystyle {\ce {{2O2F2}+2PF5->\ {2[O2]^{+}[PF6]^{-}}+F2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/165976174992525b6a5b6af7aa450412f67a6499)