塩化イッテルビウム
| 塩化イッテルビウム(III) | |
|---|---|

| |

| |
塩化イッテルビウム(III) | |
| 識別情報 | |
| CAS登録番号 | 10361-91-8 |
| ChemSpider | 55430 |
| |
| |
| 特性 | |
| 化学式 | YbCl3 |
| モル質量 | 279.40 g/mol |
| 外観 | 白色粉末 |
| 密度 | 4.06 g/cm3 (固体) |
| 融点 |
703 °C [1] |
| 沸点 |
1900 °C [1] |
| 水への溶解度 | 0.17 g/mL (25 °C) |
| 構造 | |
| 結晶構造 | 単斜晶, |
| 空間群 | C12/m1, No. 12 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化イッテルビウムは化学式YbCl3で表される塩化イッテルビウム(III)もしくは、化学式YbCl2で表される塩化イッテルビウム(II)を含む無機化合物である。本項では主に塩化イッテルビウム(III)について扱う。
歴史
[編集]ランタノイド元素の一つであるイッテルビウムは1878年にジャン・マリニャックによって発見され、その名称はスウェーデンのイッテルビー村に由来している[2]。塩化イッテルビウム(III)(以下YbCl3と示す)は1946年にHoogschagenによって初めて合成された[3]。YbCl3はYb3+イオン源として利用可能な市販試薬であるため、化学的に重要な物質である。
化学的性質
[編集]YbCl3中のYb3+の価電子はであり、それはYb3+の化学的挙動と重要な関連性を有する。また、Yb3+は、原子番号が大きくなるほど原子半径やイオン半径が小さくなるランタノイド収縮の影響でランタノイドの中では非常に小さなイオン半径を有しており[2]、このイオン半径の小ささによって速い触媒挙動を示し、原子半径の小ささ (0.99 Å) に相当して多くの重要な生物学的挙動を示す[2]。
YbCl3の熱力学的性質は、YbCl3が気層中で[YbCl6]3-[4]もしくはYb2Cl6[5]として存在することができるため、測定値を得るのが困難であった。Yb2Cl6は電子衝撃イオン化質量分析(EI法)によってYb2Cl5+として発見された[5]。また、実験データを取得する際には無数の低位なf-dもしくはf-f電子遷移が生じることによって実験データが複雑化してしまうが[6]、そのような問題があるにもかかわらずYbCl3の熱力学的性質は得られており、点群 C3v の分子対称性は4つの活性な赤外振動に基いて割り当てられた[6]。
合成
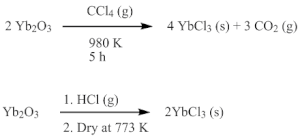
[編集]YbCl3は酸化イッテルビウム(III) (Yb2O3) を四塩化炭素[7]もしくは塩化水素[8]と高温で反応させることによって得られる。
ラボスケールの合成であれば、塩酸と塩化アンモニウムを用いる方法が単純であるものの効果的である。この方法は単純である代わりに得られるYbCl3は水和水を持っており、クロロトリメチルシランなどの試薬を用いて乾燥させることができる。他の方法としては、高純度の金属イッテルビウム粉末と塩化水銀(II)を封管中で高温に加熱することでも得られる。YbCl3を溶媒和させる手段は様々な報告がされており、金属イッテルビウムと有機ハロゲン化合物をテトラヒドロフラン (THF)のようなドナー溶媒中で反応させたり、YbCl3の水和物をクロロトリメチルシランや塩化チオニルで脱水させた後で再びTHFのような溶媒中に加える方法が含まれる。
用途
[編集]YbCl3は4f軌道に1つの不対電子を持っており、その軌道を満たすためにルイス酸としての性質を有する。YbCl3は遷移状態において通常[YbCl2]+という配位子の形で働き、例えばアルドール反応[9]やピクテ・スペングラー反応[10]のようなアルキル化反応の触媒として用いられる。
- アルドール反応
アルドール反応は有機合成化学において多目的に利用できる反応である。YbCl3はケトンエノラートとアルデヒドの間での脱炭酸アルドール反応を触媒するPd(0)触媒の助触媒として機能する。上記図の遷移状態AおよびBはイッテルビウム塩のルイス酸としての配位方法を示している[9]。Rはtert-ブチル基、R'は-(CH2)2Phを示しており、この脱炭酸アルドール反応において様々な金属塩を用いた場合の収率を示した下記表から分かるように、YbCl3はルイス酸触媒として効果的である。
| 金属塩[9] | 2の収率 (%) |
|---|---|
| FeCl3 | 40 |
| ZnCl2 | 68 |
| CuCl2 | 40 |
| LaCl3 | 60 |
| YbCl3 | 93 |
- ピクテ・スペングラー反応
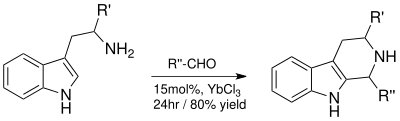
ピクテ・スペングラー反応はインドールアルカロイドを合成するための前駆体として用いられるテトラヒドロ-β-カルボリン環を生成する[10]。YbCl3をルイス酸触媒として用いた反応では生成物が高収率で得られ、反応時間も4日から24時間に短縮することができる[10]。
- エステル化反応
Yb3+のイオン半径は非常に小さいため速い触媒作用を示すが選択性が犠牲となる。例えばメソ-1,2-ジオールのモノアセチル化反応はYbCl3を触媒として用いることで反応時間は最速(2時間)となるがモノアセチル化生成物の収率は50%に留まり、反応時間が23時間かかるCeCl3を用いた場合の収率85 %という数字と比較しても生成物の選択性は低い[11]。
- アセタール化
Yb3+はオルトギ酸トリメチルを用いたアセタール化反応における強力な触媒である[12]。CeCl3やErCl3との比較においてYb3+が最も効果的な触媒であることが判明しており、上記反応式のように酸に敏感なものも含む様々なアルデヒドを室温で数分反応させるだけで高い収率が得られる。
生化学
[編集]YbCl3が接触した原子は接触していない原子と比べて異なる共鳴を生むため、核磁気共鳴スペクトル (NMR)において化学シフトの位置をシフトさせるシフト剤として利用される[13]。通常、ランタノイドの+3価イオンのような常磁性種は望ましいシフト化剤である[13]。膜生物学において39K+および23Na+のイオン運動は電気化学的勾配を立証する上で重要であり、それはYbCl3によって大いに影響される[13]。神経シグナルの伝達は生命の基礎的側面であり、YbCl3を用いたNMR技術を利用して綿密に解析される。YbCl3はまた、ナトリウムイオンプローブに類似したカルシウムイオンプローブとしても利用される[14]。
YbCl3はまた、動物の消化を追うのにも利用される。プロバイオティクスのような豚の飼料の添加物は固形もしくは液体で加えられるが、YbCl3は固形飼料に随伴して移動するため食品添加物をどの段階で飼料に加えるのが理想的かを決定するのに役立つ[15]。YbCl3の濃度はICP質量分析によって0.0009 μ g / mLの濃度まで定量することができるため[2]、そうやって分析したYbCl3濃度と時間経過の関係を取ることによって、動物の消化における微粒子の動きの情報を得ることができる。マウスを用いた実験では、YbCl3は単純に糞便として排出されて体重、臓器重量、ヘマトクリット値の変化は見られなかったため、YbCl3による動物に対する害はないとされる[14]。
YbCl3の触媒能はまたDNAマイクロアレイ(いわゆるDNAチップ)においても利用される[16]。YbCl3を用いることでターゲットDNAへのフルオレセインの導入を50から80倍に増加させることができ、結核の迅速診断のような伝染病の検出に革命をもたらした[16]。
塩化イッテルビウム(II)
[編集]塩化イッテルビウム(II)(以下YbCl2と示す)はモル質量243.95 g/mol、比重5.27 g/cm3、融点721℃の緑色固体であり、CAS No.は13874-77-6。結晶系は斜方晶であり、ピアソン記号は oP24 、空間群は Pbca, No. 61。
1929年にW.K. KlemmおよびW. SchuthがYbCl3を水素還元することによって初めて合成された。
他のYb(II)化合物や低原子価ランタノイド化合物のように、YbCl2は強い還元剤として働く。YbCl2は水溶液中で不安定であり、水を水素に還元する[17]。
出典
[編集]- ^ a b Walter Benenson, John W. Harris, Horst Stöcker (2002). Handbook of Physics. Springer. p. 781. ISBN 0-387-95269-1
- ^ a b c d Evans, C.H. Biochemistry of the Lanthanides; Plenum: New York, 1990.
- ^ Hoogschagen, J. (1946). “The light absorption in the near infra red region of praseodymium, samarium and ytterbium solutions”. Physica 11 (6): 513–517. doi:10.1016/S0031-8914(46)80020-X.
- ^ Gau, W.J.; Sun, I.W. (1996). “Electrochemical and Spectroscopic Studies of Ytterbium in the Aluminum Chloride-1-methyl-3-ethylimidazolium Chloride Room Temperature Molten Salt”. J. Electrochem. Soc. 143 (1): 170–174. doi:10.1149/1.1836403.
- ^ a b Chervonnyi, A.D.; Chervonnaya, N.A. (2004). Russ. J. Inorg. Chem. (Engl. Transl.) 49 (12): 1889–1897.
- ^ a b Zasorin, E.Z. (1988). Russ. J. Phys. Chem. (Engl. Transl.) 62 (4): 441–447.
- ^ Goryushkin, V.F.; Zalymova, S.A.; Poshevneva, A.I. (1990). Russ. J. Inorg. Chem. (Engl. Transl.) 35 (12): 1749–1752.
- ^ Jörg, S.; Seifert, H.J. (1998). “Ternary chlorides in the systems ACl/YbCl3 (A=Cs,Rb,K)”. Termochim. Acta 318: 29–37. doi:10.1016/S0040-6031(98)00326-8.
- ^ a b c Lou, S.; Westbrook, J.A.; Schaus, S.E. (2004). “Decarboxylative aldol reactions of allyl beta-keto esters via heterobimetallic catalysis”. J. Am. Chem. Soc. 126 (37): 11440–11441. doi:10.1021/ja045981k. PMID 15366881.
- ^ a b c Srinivasan, N.; Ganesan, A. (2003). Chem. Commun.: 916–917.
- ^ Clarke, P.A. (2002). “Selective mono-acylation of meso- and C2-symmetric 1,3- and 1,4-diols”. Tetrahedron Lett. 43 (27): 4761–4763. doi:10.1016/S0040-4039(02)00935-8.
- ^ Luche, Jean-Louis; Gemal, André Luis (1978). “Efficient synthesis of acetals catalysed by rare earth chlorides”. Journal of the Chemical Society, Chemical Communications 1978 (22): 976–977. doi:10.1039/c39780000976.
- ^ a b c Hayer, M.K.; Riddell, F.G. (1984). “Shift reagents for 39K Nmr”. Inorg. Chim. Acta 92 (4): L37–L39. doi:10.1016/S0020-1693(00)80044-4.
- ^ a b Shinohara, A.; Chiba, M.; Inaba, Y. (2006). “Comparative study of the behavior of terbium, samarium, and ytterbium intravenously administered in mice”. J. Alloys Cmpds. 408–412: 405–408. doi:10.1016/j.jallcom.2004.12.152.
- ^ Ohashi, Y.; Umesaki, Y.; Ushida, K. (2004). “Transition of the probiotic bacteria, Lactobacillus casei strain Shirota, in the gastrointestinal tract of a pig”. Int. J. Food Micro. 96: 61–66. doi:10.1016/j.ijfoodmicro.2004.04.001.
- ^ a b Browne, K.A. (2002). “Metal ion-catalyzed nucleic acid alkylation and fragmentation”. J. Am. Chem. Soc. 124 (27): 7950–7962. doi:10.1021/ja017746x. PMID 12095339.
- ^ ytterbium - Britannica Online Encyclopedia