塩化モリブデン(II)
| 塩化モリブデン(II) | |
|---|---|

| |
dichloromolybdenum | |
別称 molybdenum(II) chloride, molybdenum dichloride | |
| 識別情報 | |
| CAS登録番号 | 13478-17-6 (MoCl2), 11062-51-4 (Mo6Cl12) |
| PubChem | 83514 |
| ChemSpider | 75349 |
| |
| |
| 特性 | |
| 化学式 | Cl12Mo6 |
| 外観 | 黄色結晶固体 |
| 密度 | 3.17 g/cm3 |
| 融点 |
530 °C, 803 K, 986 °F |
| 水への溶解度 | low |
| 関連する物質 | |
| 関連物質 | 塩化モリブデン(III) 塩化モリブデン(IV) 塩化モリブデン(V) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化モリブデン(II)(Molybdenum(II) chloride)は、化学式MoCl2の無機化合物である。少なくとも2つの形が知られており、どちらも予期せぬ形態で、数百の誘導体が生成するという事実から、学術的に大きな関心を集めている。本項の対象は、Mo6Cl12で、もう一つは、オクタクロロ二モリブデン(II)酸カリウムK4[Mo2Cl8]である。
構造
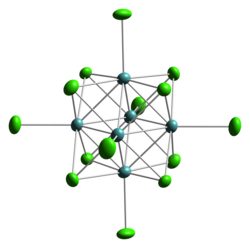
[編集]塩化カドミウム等、ハロゲン化金属に典型的な最密充填構造ではなく、塩化モリブデン(II)はクラスター構造をとる。比較的大きなイオンであるモリブデン(II)は、金属-金属結合の化合物、つまり金属クラスターを形成する傾向がある。実際に、早期遷移金属(チタン、バナジウム、クロム、マンガン)の全ての「低級ハロゲン化物」(ハロゲン化物/金属比が4未満)はそうである。Mo6Cl12は重合体で、立方体のMo6Cl84+クラスター同士が塩化物配位子で架橋される構造を持つ。2価の陰イオン[Mo6Cl14]2-の塩に容易に転換する。この陰イオンは、各々のMo原子は1つの末端塩化物配位子と結合しているが、それ以外は、8つの塩化物中心からなる立方体に埋め込まれたMo6八面体の一部を構成している。そのため、各々のMo原子の配位は、4つが塩化物配位子との三重架橋、4つがMoと隣接、1つが末端Clと結合となっている。クラスターは、各々のMo2+から4つずつ供給された24個のe-を持つ[1]。

合成と反応
[編集]Mo6Cl12は、塩化モリブデン(V)と金属モリブデンの反応により得られる。
- 12 MoCl5 + 18 Mo → 5 Mo6Cl12
この反応は、中間体として塩化モリブデン(III)と塩化モリブデン(IV)を経過するが、過剰量の金属モリブデンが存在することでその量を減らすことができる。反応は、600-650℃でチューブ炉の中で進む[2]。
単離されると、Mo6Cl12は、Mo612+核を維持して、様々な反応が進む。濃塩酸存在下で加熱すると、(H3O)2[Mo6Cl14]を与える。"ausser"(外側)と呼ばれる末端の塩化物リガンドは、置換しやすい。
- (H3O)2[Mo6Cl14] + 6 HI → (H3O)2[Mo6Cl8I6] + 6 HCl
より強い条件下では、14個全てのリガンドが置換し、[Mo6Br14]2-や[Mo6I14]2-の塩を与える。
関連クラスター
[編集]多くのクラスターが[Mo6Cl14]2-と構造的に類似している。タングステンのアナログも知られている。タングステンとニオブは、ハロゲン化物がTa6八面体の面と架橋するクラスターを形成し、[Ta6Cl18]4-となる。硫化物及びセレン化物誘導体はよく研究されている。[Re6Se8]4-は、[Mo6Cl14]2-と同じ価電子数を持っている[3]。
Mo-SクラスターMo6S86は、シェブレル相のアナログであり、ドナーリガンドLの存在下で、Mo6Cl12と硫化物を反応させることで得られる[4]。
出典
[編集]- ^ von Schnering, H. G.; May, W.; Peters, K. (1993). “Crystal structure of dodecachlorooctahedrohexamolybdenum, Mo6Cl12”. Zeitschrift für Kristallographie 208 (2): 368–369. Bibcode: 1993ZK....208..368V. doi:10.1524/zkri.1993.208.Part-2.368.
- ^ Larson, Melvin L.; Nannelli, Piero; Block, B. P.; Edwards, D. A.; Mallock, A. K. (2007). “Preparation of Some Metal Halides Anhydrous Molybdenum Halides and Oxide Halides-a Summary: Molybdenum(II) Halides”. Inorganic Syntheses. 12. pp. 165. doi:10.1002/9780470132432.ch29. ISBN 9780470132432
- ^ Lee, Sonny C.; Holm, Richard H. (1990). “Nonmolecular Metal Chalcogenide/Halide Solids and Their Molecular Cluster Analogues”. Angewandte Chemie International Edition in English 29 (8): 840. doi:10.1002/anie.199008401.
- ^ Saito, Taro (1996). “Group 6 Metal Chalcogenide Cluster Complexes and their Relationships to Solid-State Cluster Compounds”. Advances in Inorganic Chemistry. 44. pp. 45–91. doi:10.1016/S0898-8838(08)60128-2. ISBN 9780120236442