神経筋遮断薬


神経筋遮断薬(しんけいきんしゃだんやく、Neuromuscular blocking agents: NMBAs)は、神経筋接合部での神経伝達を遮断し、影響を受けた骨格筋の麻痺を引き起こすものである[1]。これはシナプス後アセチルコリン受容体への作用によって達成される。神経筋遮断薬は全身麻酔時に頻用される。
概要
[編集]臨床では、神経筋遮断薬は全身麻酔下の手術時に、運動麻痺を人為的に起こすために使用される。この麻痺は、第一に声帯を麻痺させて気管挿管を可能にし[2]、第二に自発呼吸を抑制して骨格筋を弛緩させることにより術野を最適化するためである。このような用量の神経筋遮断薬は呼吸に必要な筋肉(横隔膜など)を麻痺させる可能性があるため、適切な換気を維持するために人工呼吸(機械換気)ができるようにしておかねばならない。
このクラスの薬剤は、手術中の患者の体動、呼吸、または人工呼吸器の同期障害(専門用語でファイティングと呼ばれる[3])を軽減し、腹腔鏡操作中の気腹圧を低くするのに役立つ。集中治療室での使用にも適応がある。気管挿管時の声帯損傷やその後の声のかすれ(嗄声)を軽減するのにも役立つ。さらに、肺機能の低下した患者の機械換気を容易にする上で重要な役割を果たす。
神経筋遮断薬による運動麻痺が起こった後でも、患者は痛みを感じ、意識を持っている可能性がある。したがって術中覚醒を防ぐために、全身麻酔薬および/または鎮痛薬も投与しなければならない。
歴史上、神経筋遮断薬は南米先住民が植物から抽出したエキスであるクラーレを毒矢として用いていたのを起源とする。このクラーレがヨーロッパに持ち込まれ、1942年に有効成分として単離されたのがツボクラリンである。神経筋遮断薬は細胞膜への作用機序により、脱分極性神経筋遮断薬と非脱分極性神経筋遮断薬に大別される。ツボクラリンは非脱分極性神経筋遮断薬に属する。脱分極性神経筋遮断薬の代表は1949年に開発されたサクシニルコリンであり、神経筋遮断薬にとって最も望ましい特性である、迅速な作用発現時間と全ての筋弛緩薬の中で最短の効果時間を併せ持ち[4]、2023年時点でも用いられている[5][6]。しかし、致死率の高い合併症である悪性高熱症のリスクがあり、筋線維束攣縮に伴う高カリウム血症など副作用も多い。一方、非脱分極性遮断薬はサクシニルコリン以降にパンクロニウムやベクロニウムなど、多くの合成薬が開発されたものの、作用時間が長く、調節性が悪いという欠点をもち、この点においてサクシニルコリンを越えられなかった。さらに、非脱分極性神経筋遮断薬の効果を打ち消すのに用いられるコリンエステラーゼ阻害薬は、神経伝達物質であるアセチルコリンを無差別に増加させて、神経筋接合部だけでなく、副交感神経の神経伝達も顕著に亢進させる副作用(徐脈や分泌物増加など)をもつ。この状況に変革をもたらしたのが、パンクロニウム・ベクロニウムよりも速い効果発現時間と短い作用時間を有するロクロニウム(2007年発売)と、ロクロニウムに選択的に結合することによって、ロクロニウムの効果を強力かつ迅速に消失させる薬剤、スガマデクス(2010年発売)の登場である。スガマデクスは従来用いられてきたコリンエステラーゼ阻害薬のような、副交感神経刺激作用が無く、副作用が少ない。サクシニルコリンは緊急時の気管挿管時は有用性が大きかったものの、ロクロニウムとスガマデクスの組み合わせに駆逐される可能性が大きいと言われている[7]。
化学構造による分類
[編集]神経筋遮断薬は、2つの大きなクラスに分類される:
- Pachycurares(厚いクラーレ): 非脱分極性の厚みを持つ分子。
- Leptocurares(薄いクラーレ): 薄くて柔軟な分子で、脱分極性である[8]。また、下記のような化学構造に基づいて分類することも一般的である。
アセチルコリン、サクシニルコリン、デカメトニウム
[編集]サクシニルコリン(別名スキサメトニウム)はアセチルコリン2分子をつなげて合成されたもので、デカメトニウムと同じ数の重い原子をメトニウム基の間に持っている(デカメトニウムC×10、サクシニルコリンC×8、O×2)。サクシニルコリン、デカメトニウムが有するメトニウム基とは、トリメチル第4級アンモニウム基に挟まれたポリエチレン鎖と柔軟な結合を持つ。
アミノステロイド
[編集]-

-
 ベクロニウム
ベクロニウム -
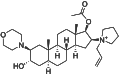 ロクロニウム
ロクロニウム
パンクロニウム、ベクロニウム、ロクロニウム、ラパクロニウム、ダクロニウム、マルエチン、ジヒドロチャンドニウム、ジピランジウム、 ピペクロニウム 、チャンドニウム(HS-310)はアミノステロイド剤である[9][10]。これらの薬剤は共通してステロイドの構造基を持ち、剛性で厚い分子構造である[10]。このカテゴリーの薬剤のほとんどは、非脱分極性薬剤に分類される。
テトラヒドロイソキノリン誘導体
[編集]アトラクリウム、ミバクリウム、ドキサクリウムのようなテトラヒドロイソキノリン骨格を持つ化合物はこのカテゴリーに入る。ミバクリウムの二重結合を除けば、これらはアンモニウム基の間に長く柔軟な鎖を持っている。D-ツボクラリンとジメチルツボクラリンもこのカテゴリーに入る。このカテゴリーの薬剤のほとんどは、非脱分極性薬剤に分類される。日本では、2024年現在、このカテゴリーの薬剤で臨床的に使用可能なものはない[注釈 1]。
ガラミンと他の化学クラス
[編集]
ガラミンは、3つの4級アンモニウム基がエーテル結合を介してフェニル環に結合したものである。他にも、アルクロニウム、アナトルクソニウム、ジアドニウム、ファザジニウム (AH8165)、トロペイニウムなど、筋弛緩作用を示すさまざまな構造が知られている。
新規神経筋遮断薬
[編集]近年、新しいタイプの第4級アンモニウム系筋弛緩薬の研究が盛んに行われている。これらは、非対称ジエステルイソキノリニウム化合物や、様々な二価酸のビスベンジルトロピニウム塩であるビスベンジルトロピニウム化合物である。これらのクラスは、より速く、より短時間で作用する筋弛緩薬を作り出すために開発された。ジエステルイソキノリニウム化合物の非対称構造とビスベンジルトロピニウム化合物のアシルオキシル化ベンジル基の両方が不安定化し、自然分解につながる可能性があるため、作用時間が短くなる可能性がある[11]。
作用機序による分類
[編集]神経筋遮断薬は2つのグループに分類される:
- 非脱分極性神経筋遮断薬: これらの薬剤は、臨床的に重要な神経筋遮断薬の大部分を占める。これらの薬剤は、アセチルコリン(ACh)とその受容体との結合を競合的に阻害することによって作用し、場合によってはACh受容体のリガンド依存性イオンチャンネル活性も直接阻害する[12]。
- 脱分極性神経筋遮断薬: これらの薬剤は、骨格筋筋繊維の筋鞘を脱分極させることによって作用する。この持続的な脱分極により、筋線維はAChによるさらなる刺激に対して抵抗性となる。
非脱分極性神経筋遮断薬
[編集]非脱分極性神経筋遮断薬とは、神経筋遮断薬の一種である。終板を脱分極させないタイプの神経筋遮断薬である[13]。非脱分極性筋弛緩薬とも呼ばれる[14]。
第4級アンモニウム筋弛緩薬はこのクラスに属する。第四級アンモニウム筋弛緩薬は、第四級アンモニウム塩を構造に含む筋弛緩薬で、麻酔に用いられることが多い。手術中に筋肉が自然に動くのを防ぐために必要である。筋弛緩剤は、ニコチン性アセチルコリン受容体をブロックすることによって、神経細胞から筋肉への神経伝達を阻害する。これらの薬に共通し、効果を発揮するために必要なのは、構造的に第4級アンモニウム基が存在することで、通常は2つ存在する。自然界に存在するものもあれば、合成された分子もある[15][8]。

以下は、シナプス後アセチルコリン受容体の部位でアセチルコリンに対する競合的アンタゴニストとして作用する、より一般的な薬剤である。
ツボクラリンは南米の植物パレイラChondrodendron tomentosumのクラーレ毒に含まれ、非脱分極性神経筋遮断薬の原型である。作用発現が遅く(5分以上)、作用時間が長い(30分)。副作用として低血圧があるが、これは血管拡張物質であるヒスタミンの放出を増加させる作用[16]と、自律神経節を遮断する作用[17]によって部分的に説明できる。尿中に排泄される。
この薬剤が神経筋伝達を破綻させ、したがって効果的な遮断が起こるためには、ACh受容体の約70~80%を遮断する必要がある。この段階では、終板電位はまだ検出できるが、筋線維収縮の活性化に必要な閾値電位に達するには小さすぎる。
ブロック開始の速度は薬剤の効力に依存し、効力が強いほどブロック開始は遅くなる。ED95が0.3mg/kgのロクロニウムは、ED95が0.05mg/kgのベクロニウムより速い。ロクロニウムやベクロニウムのようなステロイド系化合物は中間時間作用薬であり、パンクロニウムやピペクロニウムは長時間作用型である[18]。
| 薬剤 | 効果発現時間 (秒) |
作用時間 (分) |
副作用 | 臨床適応 | 保管 |
|---|---|---|---|---|---|
| ラパクロニウム (Raplon) | 気管支痙攣 | 呼吸器合併症が問題となり、2001年春に市場撤退[19] | |||
| ミバクリウム (Mivacron) | 120-180[20] | 12–20[20] | 低血圧(ヒスタミン放出により、一過性)[21] | 製造、販売、収益の懸念から販売終了 | 冷蔵 |
| アトラクリウム (Tracrium) | 180-300[20] | 20-35[20] | 低血圧(ヒスタミン放出により、一過性)[21]
毒性代謝産物のラウダノシン を生じる。特に腎不全で蓄積する。 |
広く市販されている[21]。日本では未承認 | 冷蔵 |
| ドキサクリウム (Nuromax) | 長い[21] | 低血圧(ヒスタミン放出により、一過性)[21]
毒性代謝産物のラウダノシン を生じる。痙攣閾値を下げ、特に腎不全で蓄積する。 |
日本では未承認 | ||
| シスアトラクリウム (Nimbex) | 180-300[20] | 20-35[20] | ヒスタミン放出を引き起こさない。 | 日本では未承認 | 冷蔵 |
| ベクロニウム (マスキュラックス) | 180-300[20] | 20-35[20] | まれ[21]。筋弛緩の遷延は起こり得る[21]。抗ムスカリン作用の可能性。 | 1988年にオルガノン三共より発売され[22]、広く市販されていた[21]が、2023年現在、日本では販売終了が近づいている[23]。 | 常温 |
| ロクロニウム (エスラックス) | 60-120[20] | 20-35[20] | 抗ムスカリン作用の可能性。 | 2007年にオルガノンより発売され、日本では最もよく使われている。 | 常温 |
| パンクロニウム (ミオブロック) | 180-300[20] | 60-90[24][20] | 頻脈 (軽度)[21]、低血圧は引き起こさない[21]。 | 日本では1973年に三共製薬から発売され[22]、2012年に販売終了[25] | 常温 |
| ツボクラリン (アメリゾール) | 300以上[21] | 60–120[21] | 低血圧 (神経節遮断とヒスタミン放出による)[21]
気管支痙攣(ヒスタミン放出による[21]) |
入手困難[21] | |
| ガラミン (Flaxedil) | 300以上[21] | 60–120[21] | 頻脈[26] | 日本では1967年に帝国化学産業より発売され、1970年代まで用いられた[26]。 | 常温 |
| ピペクロニウム | 120-180[27] | 70-80[27] | 頻脈 (軽度)[21]。低血圧は引き起こさない[21]。 | 常温 |
| 薬剤 | 排泄部位 | クリアランス (mL/kg/min) | ツボクラリンに対するおおよその力価 |
|---|---|---|---|
| イソキノリン誘導体 | |||
| ツボクラリン | 腎 (40%) | 2.3-2.4 | 1 |
| アトラクリウム | 自然分解 | 5-6 | 1.5 |
| シスアトラクリウム | 大半が自然分解 | 2.7 | 1.5 |
| ドキサクリウム | 腎 | 2.7 | 6 |
| メトクリン | 腎 (40%) | 1.2 | 4 |
| ミバクリウム | 血漿コリンエステラーゼ | 70-95 | 4 |
| ステロイド誘導体 | |||
| パンクロニウム | 腎 (80%) | 1.7-1.8 | 6 |
| ピペクロニウム | 腎 (60%) 、肝 | 2.5-3.0 | 6 |
| ラパクロニウム | 肝 | 6-11 | 0.4 |
| ロクロニウム | 肝 (75-90%)、腎 | 2.9 | 0.8 |
| ベクロニウム | 肝 (75-90%) 、腎 | 3-5.3 | 6 |
臨床投与量が多くなると、遮断薬の一部がイオンチャネルの孔に入り込むことがある。これは神経筋伝達を弱め、アセチルコリンエステラーゼ阻害剤(ネオスチグミンなど)の効果を減弱させる[28]。非脱分極性神経筋遮断薬はまた、神経末端でのアセチルコリンの動員を妨げるシナプス前ナトリウムチャネルを遮断することがある[28]。
脱分極性神経筋遮断薬
[編集]
脱分極性神経筋遮断薬は、終板を脱分極させる神経筋遮断薬の一種である。 脱分極性筋弛緩薬とも呼ばれる[14]。例えば、サクシニルコリン(別名スキサメトニウム)である。脱分極性神経筋遮断薬は、アセチルコリンと同様に、筋繊維の細胞膜を脱分極させることによって作用する。しかし、これらの薬剤はアセチルコリンを分解する酵素であるアセチルコリンエステラーゼによって分解されにくいため、より持続的に筋線維を脱分極させることができる。これとアセチルコリンとの違いであるが、アセチルコリンは急速に分解されるため、筋を一過性に脱分極させるだけである。
第1相(脱分極相)では、サクシニルコリンはニコチン受容体と相互作用してチャネルを開き、終板の脱分極を引き起こす。それが後に隣接する膜に広がって脱分極をもたらす。その結果、筋運動単位の収縮に乱れが生じる[28]。すなわち、筋線維が脱分極している間に筋線維束攣縮が起こる。やがて十分な脱分極が起こると、第II相(脱感作期)が始まり、筋は運動ニューロンから放出されるアセチルコリンに反応しなくなる[28]。この時点で、完全な神経筋ブロックが達成される。第I相ブロック効果はコリンエステラーゼ阻害薬により増大する。これは、コリンエステラーゼによる脱分極性神経筋遮断薬の代謝と除去の作用をさらに遅らせるものである[28][注釈 2]。
サクシニルコリンを持続的に投与すると、最初の終板の脱分極が減少し、再分極が始まる[28]。広範囲に持続する脱分極の結果、シナプスは最終的に再分極を開始する。一旦再分極すると、膜はさらなる脱分極の影響を受けにくくなる(第2相ブロック)[28]。
典型的な脱分極遮断薬はサクシニルコリン(サキサメトニウム)である。これは臨床的に用いられる唯一の脱分極性神経筋遮断薬である。サクシニルコリンは、様々なコリンエステラーゼ(血中のブチリルコリンエステラーゼ(別名: 偽コリンエステラーゼ)など)によって加水分解されるため、作用発現は30秒と速いが、作用時間は5~10分と非常に短い。患者は筋神経線維の脱分極による筋線維束攣縮を経験し、数秒後に弛緩性麻痺が起こる[18]。サクシニルコリンは構造的に2つのアセチルコリン分子がメチル基で結合したものであるため、元々はジアセチルコリンとして知られていた。デカメトニウム は、臨床で用いられることもあるが、まれである。サクシニルコリンは最速の筋弛緩薬であるため、全身麻酔の導入方法の一法である迅速導入に適している。
用量と効果発現時間
[編集]静脈内投与量は1~1.5mg/kgまたは3~5×ED95である。麻痺は1~2分で起こる。
臨床的作用時間(薬物投与から1回の麻痺がベースラインの25%に回復するまでの時間)は7~12分。
静脈内投与が不可能な場合は、3~4mg/kgを筋肉内投与する。麻痺は4分で起こる。
第2相ブロックは大量投与(4mg/kg超)後に起こり、麻痺遷延のリスクが高まる。これは、サクシニルコリンが存在するにもかかわらずシナプス後膜の活動電位がベースラインに戻り、ニコチン性アセチルコリン受容体が活性化され続けることで起こる[18]。
脱分極性と非脱分極性薬剤の比較
[編集]主な違いは、これら2種類の神経筋遮断薬に対する作用逆転(リバース)[注釈 3]にある。
- 非脱分極性遮断薬はコリンエステラーゼ阻害薬によってリバースされる。非脱分極性神経筋遮断薬はアセチルコリン受容体に対する競合的アンタゴニストであるため、アゴニストであるアセチルコリンの増加によって作用が逆転されるからである。
- 脱分極性遮断薬はすでにアセチルコリン様作用を有しているため、アセチルコリンエステラーゼ阻害薬の影響下で効果が延長する。脱分極性遮断薬を投与すると、最初に筋攣縮(麻痺が起こる直前の突然の痙攣)が起こる。これは筋の脱分極によるものである。また、術後の筋肉痛にも関連している。
テタヌス減衰(tetanic fade)とは十分に高い周波数の電気刺激で筋肉が収縮を維持できないことである。
- 非脱分極性遮断薬はおそらくシナプス前受容体に作用して患者にこのような効果をもたらす[29]。
- 脱分極性遮断薬はテタヌス減衰を引き起こさない。しかし、サクシニルコリンの反復投与により、臨床的に類似した第2相ブロックと呼ばれる症状が起こる。
この相違は、未知の神経筋遮断薬の中毒の場合には診断上有用である[29]。
| ツボクラリン | サクシニルコリン | ||
|---|---|---|---|
| Phase I | Phase II | ||
| ツボクラリン投与 | 相加的 | 拮抗的 | 増強 |
| サクシニルコリン投与 | 拮抗的 | 相加的 | 増強 |
| ネオスチグミン投与 | 拮抗的 | 増強 | 拮抗的 |
| 骨格筋への初期の興奮性作用 | なし | 筋攣縮 | なし |
| テタヌス刺激への反応 | 減弱する
(フェード) |
減弱しない
(フェード無し) |
減弱する
(フェード) |
| テタヌス刺激後攣縮 | あり | なし | なし |
| 筋弛緩の回復速度 | 30-60分 | 4-8分 | > 20分 |
神経筋接合部の病態生理
[編集]神経筋遮断薬は、骨格筋の信号伝達を調節することによってその効果を発揮する。活動電位とは言い換えれば、閾値電位以上の膜電位の変化による神経細胞膜の脱分極であり、電気インパルスが発生する。電気インパルスはシナプス前神経細胞の軸索を伝わり、神経筋接合部(NMJ)でシナプスを経て、筋収縮を引き起こす[30]。
活動電位が軸索末端に達すると、カルシウムイオンゲートチャネルが開口し、Ca2+が流入する。Ca2+はエキソサイトーシス(小胞がシナプス前膜と融合する)によって、神経伝達物質含有小胞内の神経伝達物質の放出を刺激する[30]。
神経伝達物質であるアセチルコリン(ACh)は、神経筋接合部のシナプス後膜の特殊な領域である筋線維上の終板のニコチン性アセチルコリン受容体に結合する。この結合によりニコチン性アセチルコリン受容体チャネルが開き、Na+が筋線維に流入する[30]。
放出されたアセチルコリンの50%はアセチルコリンエステラーゼによって加水分解され、残りのアセチルコリンは終板のニコチン性アセチルコリン受容体に結合する。このアセチルコリンがアセチルコリンエステラーゼによって分解されると、受容体はもはや刺激されなくなり、筋は再分極することができる[30]。
十分なNa+が筋線維に入ると、膜電位が静止膜電位の-95mVから-50mV(閾値電位-55mV以上)へと上昇し、活動電位が筋線維全体に広がる。この電位は筋鞘(サルコレマ)の表面に沿って移動する。筋鞘は、筋原線維として知られる筋内部の収縮構造を取り囲む興奮性の膜である。活動電位が筋原線維に到達するためには、活動電位は筋鞘と筋原線維の中心を結ぶ横行小管(T管)に沿って移動する[30]。
その後、活動電位は筋小胞体(筋収縮に必要なCa2+を貯蔵している)に達し、筋小胞体からCa2+を放出させる[30]。
作用機序
[編集]
第4級アンモニウム基を保つ筋弛緩薬はニコチン性アセチルコリン受容体に結合し、アセチルコリンの受容体への結合と作用を、阻害または干渉する。それぞれのアセチルコリン受容体には2つの結合部位があり、受容体を活性化するにはその両方に結合する必要がある。それぞれの結合部位は、受容体の2つのαサブユニットのうちの1つに位置している。各結合部位には2つのサブサイトがあり、カチオン性アンモニウム基に結合するアニオン性部位と、水素結合を供与して筋弛緩薬に結合する部位である[8]。
非脱分極性筋弛緩薬
[編集]アセチルコリンの結合が減少すると、その作用が低下し、筋へのシグナル伝達が起こりにくくなる。一般的に、非脱分極薬は可逆的競合阻害薬として作用することで神経筋接合部を遮断すると考えられている。つまり、アンタゴニストとして受容体に結合するため、アセチルコリンが結合できる受容体の数が少なくなる[8][31]。
脱分極性筋弛緩薬
[編集]脱分極性筋弛緩薬による神経筋遮断の機序は、アセチルコリン受容体に結合し、活性化してまず筋収縮を引き起こし、次に麻痺を引き起こすというものである。アセチルコリンと同様に受容体に結合し、チャネルを開いて脱分極を引き起こす。これは、通常のアセチルコリンによる興奮よりも長く続く反復興奮を引き起こし、アセチルコリンエステラーゼという酵素に対する抵抗性によって説明される可能性が高い。一定の脱分極とレセプターのトリガーにより、終板はアセチルコリンによる活性化に対して抵抗性を維持し続ける。したがって、正常なニューロンから筋肉への伝達は、終板が脱分極しているために筋肉の収縮を引き起こすことができず、それによって筋肉は麻痺する[8][31]。
ニコチン性アセチルコリン受容体への結合
[編集]アセチルコリンのような短い分子は、受容体を活性化するために2つの分子を必要とする。デカメトニウムは直線の立体配座(最もエネルギーが低い状態)を好むので、通常は1分子で2つの受容体の結合部位に結合する(部位間結合)。より長い同族体は受容体の結合部位に適合する際に曲がらなければならない。分子が曲がって結合部位に結合するのに必要なエネルギーが大きいほど、通常、力価は低くなる[32]。
構造活性相関
[編集]神経筋遮断薬のコンフォーメーション(立体配座)研究は比較的新しく、発展途上にある。従来の構造活性相関研究では、分子の環境因子は特定されていない。コンピューターによるコンフォーメーション検索は、分子が真空中にあることを前提としているが、生体内ではそうではない。溶媒和モデルは、分子のコンフォメーションに対する溶媒の影響を考慮したものである。しかし、溶媒和のシステムは、体内の複雑な流体組成の影響を模倣することはできない[33]。
筋弛緩薬を硬質と非硬質とに分けるのは、せいぜい定性的なものである。コンフォメーション変化に必要なエネルギーは、より正確で定量的なイメージを与えるかもしれない。長い筋弛緩薬分子鎖の第4級アンモニウム基の距離を縮めるのに必要なエネルギーは、筋弛緩薬の受容体結合部位を曲げて適合させる能力を定量化できる可能性がある[32]。コンピューターを用いると、最もエネルギーの低い状態のコンフォーマーを計算することが可能であり、その結果、最も一般的で、最もよく分子を表現している。この状態はグローバルミニマムと呼ばれる。いくつかの単純な分子のグローバルミニマムは、非常に簡単に確実に発見することができる。例えば、デカメトニウムのように、直線のコンフォーマーが明らかに最もエネルギーの低い状態である。一方、回転可能な結合が多く、グローバルミニマムは近似的にしか求められない分子もある[33]。
分子間距離と剛直性
[編集]
神経筋遮断薬は、デカメトニウムの分子長に似た2ナノメートル近いスペースに収まる必要がある[32]。デカメトニウムの同族体によっては、1つの受容部位にしか結合しないものもある。柔軟な分子は受容体結合部位にフィットする可能性が高い。しかし、最も多く存在するコンフォメーションが最も適合するものとは限らない。非常に柔軟な分子は、実際、用量反応曲線が平坦な弱い神経筋遮断薬である。一方、硬い分子や剛直な分子は、うまく適合しないか、まったく適合しない傾向がある。最もエネルギーの低いコンフォメーションがフィットする場合、最もエネルギーの低いコンフォメーションに近い分子が非常に多く存在するため、その化合物は高い効力を持つ。分子は薄くても硬くてもよい[33]。例えばデカメトニウムは、窒素原子間距離を変えるのに比較的高いエネルギーを必要とする[32]。
一般に、分子の剛直性は力価に寄与し、分子の大きさは筋弛緩剤が分極性作用を示すか脱分極作用を示すかに影響する。終板を脱分極させるためには、陽イオンがイオンチャネルの膜貫通孔を通過することができなければならない[33]。小さな分子は、剛性があり強力であるが、受容体結合部位間の領域を占有したりブロックしたりすることはできない[11]。一方、大きな分子は両方の受容部位に結合し、イオンチャネルが開いているか閉じているかに関係なく、陽イオンの脱分極を妨げることがある。脂溶性表面がシナプスの方を向いていると、陽イオンをはじくことによってこの効果が高まる。この効果の重要性は筋弛緩薬によって異なり、脱分極性ブロックと非脱分極性ブロックの分類は複雑な問題である。第4級アンモニウム基の頭部は通常小さく保たれ、頭部をつなぐ鎖は通常、窒素原子間の距離を10個のNまたはO原子に保つ。この距離を念頭において、鎖の構造は様々である(二重結合、シクロヘキシル、ベンジルなど)[33]。
サクシニルコリンは、デカメトニウムのように窒素原子間の距離が10原子ある。しかし、1つのニコチン性アセチルコリン受容体を開くには、アセチルコリンと同様に2分子が必要であることが報告されている。このコンフォメーションに関する説明は、サクシニルコリンの各アセチルコリン部分がゴーシュ型(曲がった、シス)状態を好むというものである。N原子とO原子の間の引力は4級アンモニウム基の斥力よりも大きい。この最も一般的な状態では、窒素原子間距離は最適な炭素原子10個分より短く、両方の受容体結合部位を占めるには短すぎる。サクシニルコリンとアセチルコリンのこの類似性は、アセチルコリンに似た副作用の説明にもなる[33]。分子の長さを比較すると、厚いクラーレのジメチルツボクラリンとd-ツボクラリンはともに非常に硬く、全長は1.8nmに近い。パンクロニウムとベクロニウムは1.9 nmで、ピペクロニウムは2.1 nmである。これらの化合物の力価は、その長さと同じ順位に従っている。同様に、薄いクラーレも同様の長さを好む。2nmのデカメトニウムはこのカテゴリーで最も強力だが、窒素原子間の炭素数11はやや長すぎる。ガラミンは嵩と剛直性が低いにもかかわらず、このクラスで最も強力で、その大きさは1.9nmである[11][32]。これらの情報から、脱分極作用の有無にかかわらず、神経筋遮断薬の最適な長さは2~2.1nmであると結論づけることができる[33]。
アトラクリウム、シサトラクリウム、ミバクリウム、ドキサクリウムのような長鎖ビス四級テトラヒドロイソキノリンのコンフォーメーション活性相関は、そのかさばる第4級アンモニウム基と多数の回転可能な結合と基のために決定が難しい。これらの薬剤は、他の薬剤と同じ受容体トポロジーに従わなければならず、つまり、曲げなければ受容体結合部位の間に収まらない[32]。 例えば、ミバクリウムは、引き伸ばしたときの分子長が3.6 nmであり、最適な2~2.1 nmからはかけ離れている。ミバクリウム、アトラクリウム、ドキサクリウムは曲げてもd-ツボクラリンより窒素原子間距離(N-N)と分子長が大きい。これらを適合させるために、これらの第4級アンモニウム基に有益な位置をとるチャンスを与える柔軟な結合がある。この曲がったN-Nのシナリオは、まっすぐなコンフォーメーションをとる傾向のあるラウデキシウムやデカメチレンビスアトロピウムには当てはまらないだろう[33]。
BeersとReichの法則
[編集]アセチルコリンとその関連化合物は、ニコチン性アセチルコリン受容体に結合する際、ゴーシュ型(曲がった)配置でなければならないと結論付けられている[34]。1970年のBeersとReichのコリン作動性受容体に関する研究では、化合物がムスカリン性かニコチン性か、どちらであるかに影響する関係を示した。彼らは四級窒素原子の中心からそれぞれの酸素原子(または同等の水素結合受容体)のファンデルワールス半径までの距離が決定因子であることを示した。この距離が0.44 nmであれば、その化合物はムスカリン特性を示し、0.59 nmであればニコチン特性が支配的となる[35]。
合理的設計
[編集]
パンクロニウムは、構造-作用-効果の関係データから論理的かつ合理的に設計された数少ない筋弛緩薬のひとつである。適切なサイズと剛直性からステロイド骨格が選ばれた。受容体親和性を高めるためにアセチルコリン部分が挿入された。多くの好ましくない副作用があり、作用の発現や回復速度も遅かったが、これは商業的に大きな成功を収め、かつては最も強力な、利用可能な神経筋遮断薬であった。パンクロニウムをはじめとするいくつかの神経筋遮断薬はM2受容体(ムスカリン性アセチルコリン受容体のサブタイプ)を遮断する。したがって迷走神経に作用し、低血圧と頻脈を引き起こす[要出典]。このムスカリン遮断作用は、パンクロニウムのA環上のアセチルコリン部位に関係している。

A環上のN原子を3級にすることにより、環はアセチルコリン部分を失い、結果として生じる化合物であるベクロニウムは、パンクロニウムと同等のニコチン親和性と同様の作用時間を維持しながら、ムスカリン受容体に対する親和性が100倍近く低下する。したがって、ベクロニウムは心血管系に影響を及ぼさない[8]。D環は優れた特性を示し、BeersとReichの法則を非常に正確に検証している。その結果、ベクロニウムはすべての一価四級化合物の中で最大の力価と特異性を有する[33]。
力価
[編集]2つの官能基がアミノステロイドの神経筋遮断作用に大きく寄与していることから、受容体と2点で結合することが可能であると推測される。A環とD環のビス4級2点配置(受容体結合部位間で結合する)またはD環のアセチルコリン部分(受容体結合部位内2カ所に結合する)が最も結合に成功しやすい。第3の基は様々な効果をもたらす[33]。ピペクロニウムのA環とD環にある4級基とアセチル基は、受容体の結合部位内への結合(同じ部位の2カ所に結合)を妨げる。その代わりに、ビス4級(結合部位間)として結合するはずである[11]。これらの構造はアセチルコリンとはかなり異なっており、ピペクロニウムから、アセチルコリン部分と結びついたニコチン性やムスカリン性の副作用を無くしている。また、コリンエステラーゼによる加水分解から分子を保護し、腎臓から排泄されるようにしている。第4級N原子に4つのメチル基があるため、ほとんどのアミノステロイドよりも脂溶性が低い。これにより、また、肝への取り込み、代謝、胆汁排泄がされにくく、ピペクロニウムの代謝に影響を与える。分子の長さ(2.1nm、理想に近い)とその剛直性により、ピペクロニウムは最も強力なビス4級化合物となっている。N-N間距離(1.6nm)は理想的とされる距離から遠く離れているが、アンモニウム基はよく露出しており、4級基はキラリティの問題なしにアンモニウム基をレセプターのアニオン中心に結合させるのに役立っている[33]。
一般的に2つ以上のアンモニウム基を追加しても力価は増えない。ガラミンに含まれる3番目のアンモニウム基は、2つの外側のアンモニウム基を最適な分子長の近くに配置するのに役立つようだが、不利な干渉をすることがあり、ガラミンは他の多四級化合物と同様に弱い筋弛緩剤であることが判明した。アセチルコリンについて考えると、メチル基より大きな四級基とアセチル基より大きなアシル基は分子の効力を低下させる。荷電したN原子とカルボニルO原子は受容部位で結合する構造から離れるため、効力が低下する。例えば、ベクロニウムのカルボニルO原子は、受容部位のH結合供与体に接近するように外側に突き出されている。このことは、ガラミン、ロクロニウム、ラパクロニウムが比較的低力価であることの説明にもなる[33]。一般に、メチル4級化は力価上昇に最適であるが、この規則に反して、ガラミンのトリメチル誘導体はガラミンよりも低力価である。その理由は、ガラミンのN-N距離が最適ではないからである。エチル基をメチル基で置換すると、分子長も最適より短くなる。テトラヒドロイソキノリニウム剤のメトキシ化は、その効力を向上させるようである。メトキシル化によってどのように力価が向上するかはまだ不明である。ヒスタミン放出はベンジルイソキノリニウム系筋弛緩剤の一般的な特徴である。この問題は一般に、力価が増大し、投与量が少なくなると減少する。より大量投与が必要な場合は、この副作用の程度が増加する。ヒスタミン放出を立体配座または構造的に説明することはできていない[33]。
薬物動態
[編集]代謝とホフマン脱離

ベクロニウムを3位で脱アセチル化すると、非常に活性の高い代謝物になる[36]。ラパクロニウムの場合、3位の脱アセチル化代謝物はラパクロニウムよりもさらに強力である。D環アセチルコリン部分が変化しない限り、筋弛緩作用は維持される。一方、17位の脱アシル化によって生成される第4級アミノステロイドは、一般に筋弛緩作用が弱い[33]。アトラクリウムの開発では、生体内での筋弛緩剤のホフマン脱離を用いることが主なアイデアであった。ビスベンジル-イソキノリニウム型の分子を扱う場合、適切な電子吸引基などの特徴を分子に挿入すれば、生体内の条件でホフマン消去が起こるはずである。得られた分子であるアトラクリウムは、体内で自然に分解して不活性化合物となり、腎不全や肝不全の患者に特に有用である。シスアトラクリウムはアトラクリウムとよく似ているが、より強力でヒスタミン放出の傾向が弱い[8]。
構造と作用発現時間との関係
作用発現時間に対する構造の影響については、作用発現時間が力価に反比例することを除いてはあまりよく知られていない[37]。一般に、第4級アンモニウム基が1つのアミノステロイドは2つの化合物よりも速く作用するが、これは力価も低いことを意味する。この効果の説明として考えられるのは、薬物送達と受容体結合の時間軸が異なるということである。より弱い筋弛緩薬は、より大量に投与されるため、中心コンパートメントのより多くの分子が、体内の受容体の開口部の空間である効果コンパートメントに拡散しなければならない。効果コンパートメントに送達された後、すべての分子は速やかに作用する[38]。治療上、この関係は非常に不都合である。というのも、低活性はしばしば低特異性を意味し、安全域が減少するため、副作用の可能性が高まるからである。加えて、低力価は通常、作用の発現を早めるとはいえ、速やかな効果発現を保証するものではない。例えば、ガラミンは作用が弱いのに遅効性である。現状、速い効果発現が必要な場合は、通常サクシニルコリンやロクロニウムが望ましい[33]。
医学的適応
[編集]
気管挿管
[編集]麻酔導入中に神経筋遮断薬を投与すると、気管挿管が容易になる[18]。これにより、挿管後の嗄声や気道損傷の発生率を減少させることができる[18]。
短時間(30分未満)の処置・手術に伴う麻酔中の気管挿管には短時間作用型の神経筋遮断薬が選択され、挿管後すぐに神経モニタリングが必要となる[18]。選択肢としては、サクシニルコリン、ロクロニウム、ベクロニウムなどがあり、特にロクロニウムに関してはスガマデックスがあれば迅速な筋弛緩作用の逆転が可能である[18]。
長時間の処置・手術時(30分以上)の気管挿管には、全ての短時間作用型または中間作用型の神経筋遮断薬を使用できる[18]。選択肢としては、サクシニルコリン、ロクロニウム、ベクロニウム、ミバクリウム、アトラクリウム、シスアトラクリウムなどがある[18]。これらの神経筋遮断薬の選択は、入手可能性、コスト、薬物代謝に影響する患者パラメータに依存する。
術中の筋弛緩は、必要に応じて非脱分極性筋弛緩薬を追加投与することで維持できる[18]。
すべての神経筋遮断薬の中で、サクシニルコリンが最も安定して最速の挿管条件を確立できるため、緊急気道確保手段である迅速導入(または迅速挿管)に望ましいと考えられている[18]。迅速導入におけるサクシニルコリンに代わる神経筋遮断薬としては、高用量のロクロニウム(1.2mg/kgでED95の4倍量)、あるいは高用量のレミフェンタニルによる神経筋遮断薬の使用回避がある[18]。
手術の円滑化
[編集]
非分極性神経筋遮断薬は、腹腔鏡下手術、ロボット手術、腹部手技、胸部手術などの手術条件を改善する筋弛緩を誘発するために用いられる[18]。患者の体動や筋緊張、人工呼吸器に同調しない呼吸や咳を軽減し、腹腔鏡手術の際の気腹(腹腔内に二酸化炭素を送り込む)圧を下げることができる[18]。神経筋遮断薬の投与は、患者の状態に応じて個別に行う必要がある。しかし、手術中に十分な麻酔をかけることで、神経筋遮断の理論的利点の多くを達成することができるため、神経筋遮断薬を使用しなくても多くの手術を行うことができる[18][注釈 5]。
副作用
[編集]神経筋遮断薬は横隔膜の麻痺を引き起こすことがあるため、人工呼吸器で呼吸を確保する必要がある。
神経筋遮断薬はニコチン性アセチルコリン受容体に対して完全に選択性に作用するわけでは無く、ムスカリン性アセチルコリン受容体対する作用もあるため、心血管系に影響を及ぼすことがある[17]。自律神経節や副腎髄質のニコチン性アセチルコリン受容体が遮断されると、自律神経症状を引き起こすことがある。また、神経筋遮断薬はヒスタミン放出を促進することがあり、低血圧、顔面紅潮、頻脈を引き起こす。
また、サクシニルコリンはまれに悪性高熱症を誘発する可能性がある。
筋肉を脱分極させる際、サクシニルコリンは筋線維から一過性に大量のカリウムを放出させることがある。このため患者は、高カリウム血症や不整脈など、生命を脅かす合併症の危険にさらされる。その他の作用としては、筋肉痛、胃内圧亢進、眼圧亢進、頭蓋内圧亢進、不整脈(徐脈が最も多い)、アレルギー反応などがある[18]。そのため、悪性高熱症ハイリスク患者、脱神経状態、受傷48時間以降の重度熱傷、重度の高カリウム血症には禁忌である。
ベクロニウム、ピペクロニウム、ドキサクリウム、シスアトラクリウム、ロクロニウムおよびラパクロニウムを除く非脱分極性神経筋遮断薬では、一定の心血管系作用が生じる[28]。さらに、ツボクラリンは低血圧効果をもたらすが、パンクロニウムは心拍数の中等度の増加と心拍出量のわずかな増加につながる可能性があり、体血管抵抗(systemic vascular resistance: SVR)がほとんど増加しないのは、神経筋遮断薬の中では特異である[28]。
アミノグリコシド系抗生物質やポリミキシンのようなある種の薬物や一部のフルオロキノロン系抗菌薬にも神経筋遮断作用がある[39]。
相互作用
[編集]
薬剤の中には、神経筋遮断薬に対する反応を増強または阻害するものがあり、筋弛緩モニターによって投与量を調節する必要がある。
神経筋遮断薬の併用
[編集]臨床状況によっては、非脱分極性神経筋遮断薬の投与前後にサクシニルコリンを投与したり、2種類の非脱分極性神経筋遮断薬を順番に投与したりすることがある[18]。異なる神経筋遮断薬を併用すると神経筋ブロックの程度が異なることがあるので、筋弛緩モニタを用いて管理する。
非脱分極性神経筋遮断薬の投与は、その後のサクシニルコリンによる脱分極ブロックに対して拮抗作用を示す[18]。サクシニルコリンの前に非脱分極性神経筋遮断薬を投与する場合は、サクシニルコリンの投与量を増やす必要がある。
非脱分極性神経筋ブロックの後にサクシニルコリンを投与するかどうかは用いる薬剤によって異なる。非脱分極性神経筋遮断薬の前にサクシニルコリンを投与してもミバクリウムやロクロニウムの効力に影響を与えないという研究結果がある[18]。しかし、ベクロニウムとシスアトラクリウムについては、効果発現を早め、効力を増加させ、作用時間を延長させる[18]。
同じ化学クラスの2つの非脱分極性神経筋遮断薬(例:ロクロニウムとベクロニウム)を組み合わせると相加効果が生じ、異なる化学クラスの2つの非脱分極性NMBA(例:ロクロニウムとシスアトラクリウム)を組み合わせると相乗効果が生じる[18]。
吸入麻酔薬
[編集]吸入麻酔薬はニコチン性アセチルコリン受容体を阻害し、非脱分極性神経筋遮断薬による神経筋遮断を増強する[18]。これは揮発性麻酔薬の種類(デスフルラン>セボフルラン>イソフルラン>亜酸化窒素)、濃度、暴露時間によって異なる[18][40]。
抗生物質
[編集]テトラサイクリン、アミノグリコシド、ポリミキシンおよびクリンダマイシンは、アセチルコリンの放出阻害またはシナプス後アセチルコリン受容体のアセチルコリンへの脱感作によって神経筋遮断を増強する[18]。この相互作用は主に麻酔維持中に起こる。通常、抗生物質は神経筋遮断薬とよく併用されるため、神経筋遮断薬を再投与する際にはこの相互作用を考慮する必要がある[18]。
抗痙攣薬
[編集]抗痙攣薬の長期投与慢性治療を受けている患者は、クリアランスが促進されるため、非脱分極性神経筋遮断薬に対して比較的抵抗性がある[18]。
リチウム
[編集]リチウムはナトリウム、カリウム、マグネシウム、カルシウムなどの他の陽イオンと構造的に類似しているため、リチウムは神経筋伝達を阻害するカリウムチャネルを活性化する[18]。リチウムを服用している患者は、脱分極性および非脱分極性神経筋遮断薬に対する反応が延長することがある。
抗うつ薬
[編集]セルトラリンとアミトリプチリンはブチリルコリンエステラーゼを阻害し、遷延性麻痺を引き起こす[18]。ミバクリウムはセルトラリンを慢性的に服用している患者に遷延性麻痺を引き起こす[18]。
局所麻酔薬
[編集]局所麻酔薬は、神経筋接合部におけるシナプス前後の相互作用を通じて、脱分極性および非脱分極性神経筋遮断薬の作用を増強する可能性がある[18]。その結果、局所濃度が高くなり、神経筋遮断薬による神経筋ブロックが増強される可能性がある[18]。局所麻酔薬であるレボブピバカインおよびメピバカインの硬膜外投与は、アミノステロイド系神経筋遮断薬を増強し、神経筋遮断からの回復を遅延させる[18]。
糖尿病
[編集]糖尿病患者では、臨床的に神経障害症状が無くても神経伝導速度は低下し、神経筋遮断薬からの回復は遅くなる[41]。糖尿病患者では、ネオスチグミンによるリバースは健常者よりも筋弛緩状態からの回復が遅れるが、スガマデクスでは差が無いようである[41]。
効果判定
[編集]神経筋遮断の程度を推定する方法には、表面電極からの刺激に対する筋反応を評価する方法があり、例えば、4つの刺激を連続して与える4連刺激(Train of four: TOF)がある。神経筋遮断がない場合、得られる筋収縮の強さは等しいが、神経筋遮断がある場合は徐々に減少する[42]。集中治療室で神経筋遮断薬を持続注入で用いる際に推奨される[43]。
リバース
[編集]非脱分極性神経筋遮断薬の効果は、アセチルコリンエステラーゼ阻害薬である、ネオスチグミンやエドロホニウムなどを用いて逆転することができる(麻酔科領域ではリバース、拮抗と呼ばれる)。これらのうち、エドロホニウムはネオスチグミンよりも作用発現が速いが、深い神経筋ブロックのリバースに用いる場合には信頼性に欠ける[44]。アセチルコリンエステラーゼ阻害薬は神経筋接合部のアセチルコリン量を増加させるだけなので、その効果を発揮するためには神経筋ブロックが完全でないことが前提条件となる。なぜなら、全てのアセチルコリン受容体が遮断されていれば、アセチルコリンがどれだけ存在していても意味が無いからである。
スガマデクスは、全身麻酔におけるロクロニウムとベクロニウムによる神経筋ブロックを逆転させる新しい薬剤である。日本では2010年にシェリング・プラウから発売された[45]。最初の選択的筋弛緩薬結合薬(SRBA)である[46]。ロクロニウムやベクロニウムに直接結合して不活性化するという点で従来のリバース薬と根本的に作用機序が異なる[47]。本剤とロクロニウムを組み合わせる事で、筋弛緩作用の調節性が劇的に高まった。気道確保の安全性向上に大きく貢献している薬剤である。麻酔科学上のインパクトは"ゲームチャンジャー"とすら称される[48][49][50]。
歴史
[編集]
クラーレは、南米のStrychnos属とChondrodendron属の植物から抽出される粗製エキスであり、矢毒に用いられていた[51][52]。探検家ウォルター・ローリーは著書で南米先住民の矢毒について言及したが、それはおそらくクラーレでは無かった[53]。16世紀の化学者であり医師でもあったエドワード・バンクロフトは、南米からクラーレのサンプルを旧世界に持ち帰った[54]。クラーレの効果は、ベンジャミン・ブロディーによって実験され、1811年と1812年に発表された[55][56]。彼が小動物にクラーレを注射したところ、動物は呼吸を止めたが、ふいごで肺を膨らませることで生き続けることができた[55][56]。この観察から、クラーレは呼吸筋を麻痺させるという結論が導き出された[56]。クラーレは1814年にチャールズ・ウォータートンによっても実験されている。彼は雌のロバにクラーレを注射し、麻痺後に気管切開を行ってふいごを使って人工呼吸を行った[57]。
19世紀には、クロード・ベルナールのような科学者の研究により、麻痺作用があることが知られていた[58]。神経科医のウォルター・フリーマンはクラーレのことを知り、多発性硬化症に苦しんでいた植物採集家のリチャード・ギルにクラーレを使ってみるよう勧めた。ギルはエクアドルから25ポンドの生のクラーレを持ってきた。この生のクラーレは、分析のためにスクイブ・アンド・サンズ(現ブリストル・マイヤーズ)社に提供された[59][60]。1942年、ウィンターシュタイナーとダッチャー(同社で働く2人の科学者)はChondrodendron tomentosumから、モノ4級アルカロイドのd-ツボクラリンを単離し、麻痺効果をもたらすクラーレの主要成分であることを見いだした。その直後、彼らはイントコストリンと呼ばれるクラーレの製剤を開発した。当時、クラーレ、ひいてはd-ツボクラリンが神経筋接合部に作用することは知られていた。ツボクラリンが単離され、「イントコストリン」として販売されたことで、神経筋遮断薬の研究がさらに進んだ。1946年、ツボクラリンの効力が2つの4級アンモニウム基の間の距離に関係していることが突き止められた[15][61]。
1942年、モントリオールでは、ホメオパシー病院のハロルド・グリフィスは、虫垂切除術を受けた若い患者にクラーレを投与した[62][63]。これが臨床麻酔における筋弛緩剤としての神経筋遮断薬の最初の使用であった[62][63]。適切な筋弛緩なしに手術を行うこと、特に腹部の創を閉じることは大変困難であり、クラーレの臨床応用は外科学や麻酔科学に大きな進歩をもたらした[62]。

1940-1960年代には、いくつかの合成神経筋遮断薬が急速に開発された。1947年にイタリア人の薬理学者、ダニエル・ボベットが開発したガラミンは臨床使用された最初の合成神経筋遮断薬であった[60]。さらに研究が進み、第4級アンモニウム基間の距離によって異なるクラーレ様作用を持つ合成分子が開発された。合成されたビス四級アンモニウムのひとつがデカメトニウムである[60]。デカメトニウムは、ブロック前の筋肉の反応を増強するという点で従来と異なるブロック効果を示した[60]。また、ツボクラリンの効果はアセチルコリンエステラーゼ阻害剤によって可逆的であることが知られていたが、デカメトニウムのブロックは可逆的ではなかった[8][15][60]。デカメトニウムの研究に続いて、1949年、ダニエル・ボベットはアセチルコリン2分子のアセチル末端を結合させたサクシニルコリンも開発した[60]。後に開発されたものも含めて合成筋弛緩薬の多くは、使われなくなったが、サクシニルコリンは2023年現在も用いられている。この発見と開発により、1957年に彼にノーベル生理学・医学賞が授与された[60]。日本では、森岡亨(後の熊本大学医学部麻酔科初代教授[64])が、1953年にサクシニルコリンを麻酔薬を併用せず、人工呼吸の準備をすることもなく、自らに投与してその効果(筋線維束攣縮に伴う全身の筋痙攣、その後の呼吸停止)を恐怖と共に報告した[65]。後年、オーストラリアの麻酔科医達も自ら互いに、意識がある状態でサクシニルコリンやロクロニウムを投与し、その報告が2024年2月に麻酔科の学術誌 "Anesthesiology"に掲載された[66]が、彼らのある者はこのように術懐した。
I honestly felt that I was going to die.「正直死ぬかと思った」—@armyemdoc (2024年2月8日). "Anesthesiologists: "We're just completely normal people"". X(旧Twitter)より2024年2月9日閲覧。
1960年、ビス4級ステロイドである別の化合物マルエチンが植物Malouetia bequaertianaから単離され、クラーレ様活性を示した[67]。これが、ビス四級ステロイドの合成薬パンクロニウムにつながり、その後、より優れた薬理学的特性を持つ他の薬物も開発された[15][68]。これらの分子の研究から、神経細胞と受容体の生理学的知見が深まっていった。
社会
[編集]日本ではサクシニルコリンは、製造方法が日本薬局方に則っていないことが判明して2023年初頭に供給停止寸前となった[69]ものの、同年5月以降臨床使用再開見込みとなっている[70]。
脚注
[編集]注釈
[編集]- ^ 2024年現在、日本でヒト向けに市販されているのはロクロニウム、ベクロニウム、サクシニルコリンのみである。
- ^ 非脱分極性神経筋遮断薬はコリンエステラーゼ阻害薬により、作用は減弱する。
- ^ 臨床医学、特に麻酔科学では神経筋遮断薬の作用消失薬、すなわち逆転薬を「拮抗薬」と称することが多いが、神経筋遮断薬の作用は本来、神経筋接合部の作動薬であるアセチルコリンの拮抗薬であるため、逆転薬は少なくともアンタゴニストではない。
- ^ ツボクラリンもサクシニルコリンも薬理学的には代表的ではあるが、改良された薬剤、例えばロクロニウムが開発されたので臨床的には代表の座を失っている。
- ^ 例えば、十分に鎮痛し、十分に深く鎮静すれば、身体が動くことは稀になる。麻酔の3要素を参照。
出典
[編集]- ^ 高久史麿『ステッドマン医学大辞典』(第5版)メジカルビュー社、2002年2月20日、35頁。ISBN 4-7583-0000-3。
- ^ Jahromi, Behdad, Knezevic, Nebojsa & Nick MD, PhD. (2020). Neuromuscular Block Monitoring in Patients With Facial Rejuvenation: A Case Report. A&A Practice, 14, e01334. doi:10.1213/XAA.0000000000001334
- ^ “人工呼吸器のファイティングでの波形を解説【直し方も伝授します】 | コキュトレ”. pulmonary-training.com. 2023年11月25日閲覧。
- ^ 岩崎寛 2010, pp. 6–7.
- ^ “スキサメトニウム注射剤の安定供給について”. 公益社団法人日本麻酔科学会. 2022年11月29日閲覧。
- ^ “【周知】スキサメトニウム製造再開承認に際して|公益社団法人 日本麻酔科学会”. anesth.or.jp. 2023年5月18日閲覧。
- ^ 岩崎寛 2010, p. 256.
- ^ a b c d e f g h W. C. Bowman (2006). “Neuromuscular block”. British Journal of Pharmacology 147 (S1): S277–S286. doi:10.1038/sj.bjp.0706404. PMC 1760749. PMID 16402115.
- ^ Thomas L. Lemke; David A. Williams (24 January 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 336–337. ISBN 978-1-60913-345-0
- ^ a b “The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances”. 世界保健機関. 2014年10月22日時点のオリジナルよりアーカイブ。2014年10月22日閲覧。
- ^ a b c d Lee, C. (2001). “Structure, conformation and action of neuromuscular blocking drugs”. British Journal of Anaesthesia 87 (5): 755–769. doi:10.1093/bja/87.5.755. PMID 11878528.
- ^ “Open channel and competitive block of the embryonic form of the nicotinic receptor of mouse myotubes by (+)-tubocurarine”. J. Physiol. 495 (Pt 1): 83–95. (1996). doi:10.1113/jphysiol.1996.sp021575. PMC 1160726. PMID 8866353.
- ^ Neuromuscular Nondepolarizing Agents - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- ^ a b “麻酔薬および麻酔関連薬使用ガイドライン 第3版 Ⅵ 筋弛緩薬・拮抗薬”. 日本麻酔科学会. 2024年1月2日閲覧。
- ^ a b c d Raghavendra, T. (2002). “Neuromuscular blocking drugs: discovery and development”. Journal of the Royal Society of Medicine 95 (7): 363–367. doi:10.1177/014107680209500713. PMC 1279945. PMID 12091515.
- ^ “Histamine antagonists and d-tubocurarine-induced hypotension in cardiac surgical patients”. Clin. Pharmacol. Ther. 40 (5): 575–80. (1986). doi:10.1038/clpt.1986.226. PMID 2429800.
- ^ a b “Adverse reactions and interactions of the neuromuscular blocking drugs”. Medical Toxicology and Adverse Drug Experience 4 (5): 351–68. (1989). doi:10.1007/bf03259917. PMID 2682131.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af “Clinical use of neuromuscular blocking agents in anesthesia”. UpToDate. 2020年4月20日閲覧。
- ^ 岩崎寛 2010, p. 208.
- ^ a b c d e f g h i j k l 岩崎寛 2010, p. 216.
- ^ a b c d e f g h i j k l m n o p q r s Rang, H. P. (2003). Pharmacology. Edinburgh: Churchill Livingstone. p. 151. ISBN 978-0-443-07145-4. OCLC 51622037
- ^ a b 岩崎寛 2010, p. 8.
- ^ “ロクロニウム製剤の使用について”. 日本麻酔科学会 (2020年6月5日). 2022年12月30日閲覧。
- ^ Das, Gyan N.; Sharma, Piyush; Maani, Christopher V. (2023), Pancuronium, StatPearls Publishing, PMID 30855929 2023年11月15日閲覧。
- ^ “平成24年3月31日限りで廃止となる経過措置医薬品” (Excel). 社会保険診療報酬支払基金 (2012年3月5日). 2016年4月27日閲覧。
- ^ a b 岩崎寛 2010, p. 7.
- ^ a b “Pipecuronium - an overview | ScienceDirect Topics”. www.sciencedirect.com. 2023年11月14日閲覧。
- ^ a b c d e f g h i j k Katzung, Bertram G. (2011). Basic and Clinical Pharmacology (8 ed.). Lange Medical Books/McGraw-Hill. pp. 446–461. ISBN 9780071179683
- ^ a b Flower, Rod; Rang, Humphrey P.; Dale, Maureen M.; Ritter, James M. (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 978-0-443-06911-6
- ^ a b c d e f “Neuromuscular Junction | Structure, Function, Summary & Clinical” (英語). The Human Memory (2019年11月26日). 2020年4月22日閲覧。
- ^ a b “Goodman & Gilman's The pharmacological basis of Therapeutics”. New York: McGraw-Hill. (2006年). pp. 220–223. ISBN 0071624422
- ^ a b c d e f Lee, C.; Jones, T. (2002). “Molecular conformation–activity relationship of decamethonium congeners”. British Journal of Anaesthesia 88 (5): 692–699. doi:10.1093/bja/88.5.692. PMID 12067008.
- ^ a b c d e f g h i j k l m n o Lee, Chingmuh (2003). “Conformation, action and mechanism of action of neuromuscular blocking muscle relaxants”. Pharmacology and Therapeutics 98 (2): 143–169. doi:10.1016/S0163-7258(03)00030-5. PMID 12725867.
- ^ “Binding of semirigid nicotinic agonists to nicotinic and muscarinic receptors”. Molecular Pharmacology 36 (1): 177–184. (1 July 1989). PMID 2747625.
- ^ Beers, W.H; E. Reich (1970). “Structure and Activity of Acetylcholine”. Nature 228 (5275): 917–922. Bibcode: 1970Natur.228..917B. doi:10.1038/228917a0. PMID 4921376.
- ^ “The pharmacodynamics and pharmacokinetics of the metabolite 3- desacetylvecuronium (ORG 7268) and its parent compound, vecuronium, in human volunteers”. The Journal of Pharmacology and Experimental Therapeutics 270 (3): 1216–1222. (1 September 1994). PMID 7932174.
- ^ “Molar potency is predictive of the speed of onset of neuromuscular block for agents of intermediate, short and ultrashort duration”. Anesthesiology 90 (2): 425–431. (1999). doi:10.1097/00000542-199902000-00016. PMID 9952148.
- ^ Donati, F.; Claude Meistelman (2005). “A kinetic-dynamic model to explain the relationship between high potency and slow onset time for neuromuscular blocking drugs”. Journal of Pharmacokinetics and Pharmacodynamics 19 (5): 537–552. doi:10.1007/BF01062962. PMID 1783991.
- ^ Paradelis, A. G.; Triantaphyllidis, C.; Logaras, G. (1976). “Neuromuscular Blocking Activity of Aminoglycoside Antibiotics”. Pharmacology of Antibiotics. pp. 359. doi:10.1007/978-1-4684-3123-0_51. ISBN 978-1-4684-3125-4
- ^ 岩崎寛 2010, pp. 250–251.
- ^ a b Ignacio, Armendariz-Buil; Felix, Lobato-Solores; Lucianob, Aguilera-Celorrio (2016). “Diabetes Mellitus and Neuromuscular Blockade: Review” (英語). Journal of Diabetes & Metabolism 7 (6): 1–4. doi:10.4172/2155-6156.1000678. ISSN 2155-6156.
- ^ thefreedictionary.com > train-of-four Citing: Mosby's Medical Dictionary, 8th edition.
- ^ Strange, C.; Vaughan, L.; Franklin, C.; Johnson, J. I. M. (1997). “Comparison of Train-of-Four and Best Clinical Assessment during Continuous Paralysis”. American Journal of Respiratory and Critical Care Medicine 156 (5): 1556–1561. doi:10.1164/ajrccm.156.5.9701079. PMID 9372675.
- ^ Shorten, G. D.; Ali, H. H.; Goudsouzian, N. G. (1993). “Neostigmine and edrophonium antagonism of moderate neuromuscular block induced by pancuronium or tubocurarine”. British Journal of Anaesthesia 70 (2): 160–162. doi:10.1093/bja/70.2.160. PMID 8435259.
- ^ “筋弛緩回復剤「ブリディオン静注」を発売 シェリング・プラウ|薬事日報ウェブサイト” (2010年4月26日). 2023年11月16日閲覧。
- ^ Naguib, M (2007). “Sugammadex: another milestone in clinical neuromuscular pharmacology”. Anesth Analg 104 (3): 575–81. doi:10.1213/01.ane.0000244594.63318.fc. PMID 17312211.
- ^ 岩崎寛 2010, pp. 186–187.
- ^ Michael W, Lew; Joseph, Chang (2020-06-04). “Sugammadex-Is Cost the Only Drawback?”. International Journal of Anesthetics and Anesthesiology 7 (2). doi:10.23937/2377-4630/1410108.
- ^ “Reversal of Neuromuscular Blockade by Sugammadex for Stimulator-Guided Nerve Blocks After Tracheal Intubation: Is It Necessary? | AJA Asian Journal of Anesthesiology” (英語). www.aja.org.tw. 2023年1月5日閲覧。
- ^ Hung, Orlando; McKeen, Dolores; Huitink, Johannes (2016-08-01). “Our love-hate relationship with succinylcholine: Is sugammadex any better?” (英語). Canadian Journal of Anesthesia/Journal canadien d'anesthésie 63 (8): 905–910. doi:10.1007/s12630-016-0664-4. ISSN 1496-8975.
- ^ Gibson, Arthur C.. “Curare, a South American Arrow Poison”. Plants and Civilization. UCLA Mildred E. Mathias Botanical Garden, University of California, Los Angeles. 2012年7月28日時点のオリジナルよりアーカイブ。2012年7月28日閲覧。
- ^ La Oficina del Indice Histórico de Puerto Rico [The Office of the Historical Index of Puerto Rico] (1949) (スペイン語). Tesauro de datos historicos: Indice compendioso de la literatura histórica de Puerto Rico, incluyendo algunos datos inéditos, periodísticos y cartográficos, Tomo II [Thesaurus of historical data: Comprehensive index of Puerto Rico's historical literature, including some unpublished, journalistic and cartographic data, Volume II]. San Juan, Puerto Rico: El Gobierno de Puerto Rico. p. 306 2020年1月4日閲覧。
- ^ Carman, J. A.; Ave, Manor (1968-12). “History of curare” (英語). Anaesthesia 23 (4): 706–707. doi:10.1111/j.1365-2044.1968.tb00142.x. ISSN 0003-2409.
- ^ Finger, Stanley (2011-09-22). “14 14 Edward Bancroft’s Guiana Eels and London Connections”. The Shocking History of Electric Fishes: From Ancient Epochs to the Birth of Modern Neurophysiology. Oxford Academic. pp. 217-229
- ^ a b Brodie, Benjamin Collins (1812). “XI. Further Experiments and Observations on the Action of Poisons on the Animal System. By B. C. Brodie, Esq. F. R. S. Communicated to the Society for the Improvement of Animal Chemistry, and by them to the Royal Society”. Philosophical Transactions (The Royal Society) 102: 205–227. doi:10.1098/rstl.1812.0013.
- ^ a b c Brodie, Benjamin Collins (1811). “X. Experiments and Observations on the different Modes in which Death is produced by certain vegetable Poisons. By B. C. Brodie, Esq. F. R. S. Communicated by the Society for promoting the Knowledge of Animal Chemistry”. Philosophical Transactions (The Royal Society) 101: 178–208. doi:10.1098/rstl.1811.0011.
- ^ “CURARE (Chondrodendron tomentosum - Menispermaceae): From Arrow Poison to Surgical Muscle Relaxant”. Ye Olde Log (n.d.). 2008年5月9日時点のオリジナルよりアーカイブ。2017年8月23日閲覧。
- ^ Bernard, C (1857). “25th lesson” (フランス語). Leçons sur les effets des substances toxiques et médicamenteuses. Paris: J.B. Baillière. pp. 369–80
- ^ Humble, R. M. (1982-12). “The Gill-Merrill expedition: penultimate chapter in the curare story”. Anesthesiology 57 (6): 519–526. doi:10.1097/00000542-198212000-00014. ISSN 0003-3022. PMID 6756214.
- ^ a b c d e f g Raghavendra, Thandla (2002-07). “Neuromuscular Blocking Drugs: Discovery and Development” (英語). Journal of the Royal Society of Medicine 95 (7): 363–367. doi:10.1177/014107680209500713. ISSN 0141-0768.
- ^ Nedergaard, O. A. (2003). “Curare: Flying death”. Pharmacology & Toxicology 92 (4): 154–5. doi:10.1034/j.1600-0773.2003.920402.x. PMID 12753415.
- ^ a b c Czarnowski, Charles; Bailey, Jason; Bal, Sharon (2007-09-01). “Curare and a Canadian connection” (英語). Canadian Family Physician 53 (9): 1531–1532. ISSN 0008-350X.
- ^ a b Sykes, Keith (1993-04-01). “The Griffith legacy” (英語). Canadian Journal of Anaesthesia 40 (4): 365–374. doi:10.1007/BF03009637. ISSN 1496-8975.
- ^ “歴史 | 熊本大学 医学部麻酔科学教室”. kuma-ma.com (2023年2月12日). 2023年11月15日閲覧。
- ^ 岩崎寛 2010, p. 6.
- ^ Schuller, Peter J.; Voss, Logan J.; Barry, John J. (2024-02-01). “Awake Total Neuromuscular Blockade as Experienced by Anesthesiologist Volunteers” (英語). Anesthesiology 140 (2): 336–338. doi:10.1097/ALN.0000000000004808. ISSN 0003-3022.
- ^ Janot, M. M.; Laine, F.; Goutarel, R. (1960-09). “[Steroid alkaloids. V. Alkaloids of Malouetia bequaertiana E. Woodson (Apocynaceae): funtuphyllamine B and malouetine. Preliminary communication”]. Annales Pharmaceutiques Francaises 18: 673–677. ISSN 0003-4509. PMID 13789457.
- ^ McKenzie, A. G. (2000). “Prelude to pancuronium and vecuronium”. Anaesthesia 55 (6): 551–556. doi:10.1046/j.1365-2044.2000.01423.x. PMID 10866718.
- ^ “スキサメトニウム注射剤の安定供給について|公益社団法人 日本麻酔科学会”. anesth.or.jp. 2023年1月16日閲覧。
- ^ “【周知】スキサメトニウム製造再開承認に際して|公益社団法人 日本麻酔科学会”. anesth.or.jp. 2023年5月18日閲覧。
参考文献
[編集]- 岩崎寛『筋弛緩薬』克誠堂、2010年9月15日。ISBN 9784771903739。
関連項目
[編集]- 神経節遮断薬(Ganglionic blocker) - 神経筋遮断薬と紛らわしい名称の薬剤分類。臨床的には用いられる機会が激減した。
外部リンク
[編集]