방향족화

방향족화(芳香族化, 영어: aromatization)는 단일 비방향족 전구체로부터 방향족 시스템이 형성되는 화학 반응이다. 전형적인 방향족화는 기존의 고리 화합물의 탈수소화에 의해 이루어지며, 대표적인 예로 사이클로헥세인을 벤젠으로 전환시키는 반응이 있다. 방향족화에는 헤테로고리 시스템의 형성이 포함된다.[1]
산업적인 관행
[편집]
방향족화라는 이름으로 실행되지는 않지만, 방향족화는 정유 공정의 초석이다. 주요 개질 반응 중 하나는 나프텐을 방향족 화합물로 탈수소화하는 것이다. 백금에 의해 촉매되는 과정의 예는 메틸사이클로헥세인(나프텐)을 톨루엔(방향족 화합물)로 전환하는 것이다.[2] 탈수소고리화는 파라핀(비고리형 탄화수소)를 방향족 화합물로 전환시킨다.[3] 관련된 방향화 공정에는 메틸사이클로펜테인의 벤젠으로의 탈수소이성질화가 포함된다.
생화학적 과정
[편집]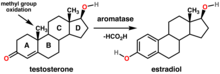
방향족화효소는 스테로이드를 부분적으로 방향족화시키는 효소이다. 구체적인 전환은 테스토스테론에서 에스트라다이올로 안드로스텐다이온에서 에스트론으로의 전환이다.[4] 이러한 각각의 방향족화는 C-19 메틸기를 폼산으로 산화시켜 방향족 시스템을 형성하게 하고, 이러한 전환은 폐경 후 여성의 유방암 및 난소암 남성의 여성형유방증의 발병에서 에스트로젠 종양 발생의 필수적인 부분이다.[5] 엑스메스탄(방향족화효소와 영구적인 결합하여 불활성화시킴),[6] 아나스트로졸, 레트로졸(효소에 대해 기질과 경쟁함)[7]과 같은 방향족화효소 저해제는 에스트라다이올의 형성을 막기 때문에 타목시펜과 같은 항에스트로젠 약물보다 더 효과적인 것으로 나타났다.[5]
방향족화 경로
[편집]산화적 탈수소화
[편집]
사이클로헥세인, 사이클로헥센, 사이클로헥사다이엔의 경우 탈수소화는 방향족화를 위한 개념적으로 가장 간단한 경로이다. 활성화 에너지 장벽은 불포화 정도에 따라 감소한다. 따라서 사이클로헥사다이엔은 특히 방향족화되기 쉽다. 공식적으로 탈수소화는 산화환원반응이다. 탈수소 방향족화는 아렌 수소화의 반대 과정이다. 따라서 수소화 촉매는 역반응에 효과적이다. 사이클로헥세인 및 관련 공급 원료의 백금 촉매 탈수소화는 이 반응의 가장 큰 규모의 적용이다(위 참조).[1]
2,3-다이클로로-5,6-다이사이아노-1,4-벤조퀴논(DDQ)이 종종 선택되는 시약이다. DDQ와 산 촉매는 이중 메틸 이동을 수반하는 산화에 의해 페난트렌 코어와 스테로이드를 합성하는 데 사용되었다.[8] 이 과정에서 DDQ는 그 자체로 방향족 하이드로퀴논 생성물로 환원된다.
황과 셀레늄은 전통적으로 방향족화에 사용되었으며, 이탈기는 황화 수소이다.[9]
가용성 전이 금속 착물은 착물화와 함께 산화적 방향족화를 유도할 수 있다. α-펠란드렌 (2-메틸-5-아이소-프로필-1,3-사이클로헥사다이에)은 염화 루테늄(III)의 환원과 함께 p-아이소-프로필톨루엔으로 산화된다.[10]
다이하이드로피리딘의 산화적 탈수소화는 방향족화를 일으켜 피리딘을 생성한다.[11]
탈수
[편집]
비방향족 고리는 여러 가지 방법으로 방향족화될 수 있다. 산성 조건 하에서 탈수는 2-사이클로헥센온 옥심을 아닐린으로의 세믈러-볼프 변환을 가능하게 한다.[12]
호변이성질화
[편집]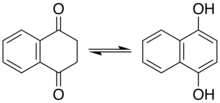
사이클로헥사다이엔온의 이성질화는 방향족 호변이성질체인 페놀을 생성한다.[13][14] 200 °C에서 1,4-나프탈렌다이올의 이성질화는 케토형인 1,4-다이옥소테트랄린과 함께 2:1 혼합물을 생성한다.[15]
수소화물과 양성자 제거
[편집]
고전적으로 방향족화 반응은 기질의 C:H 비율을 변경하는 것을 포함한다. 사이클로펜타다이엔에 적용될 때 양성자의 제거는 사이클로펜타다이엔화 나트륨으로 분리 가능한 방향족 짝염기인 사이클로펜타다이엔일 음이온을 생성한다.[16]
- 2 Na + 2 C5H6 → 2 NaC5H5 + H2
방향족화는 수소화물 제거를 수반할 수 있다. 트로필륨 이온(C
7H+
7)은 사이클로헵타트라이엔과 수소화물 수용체의 방향족화 반응에 의해 생성된다.
- C
7H
8 + Br
2 → C
7H+
7 + Br−
+ HBr
비고리형 전구체로부터
[편집]
비고리형 전구체의 방향족화는 정제 공장에서 BTX 생산의 중요한 구성 요소이지만, 유기 합성에서는 드물다.
비고리형 전구체 중에서 알킨은 부분적으로 탈수소화되기 때문에 상대적으로 방향족화되기 쉽다. 버그만 고리화는 엔다이인을 디하이드로벤젠 중간생성물 다이라디칼로 전환하여 수소를 제거하여 방향족화된다.[17] 엔다이인 부분은 기존의 고리 내에 포함될 수 있으며, 반응물에서 고리 변형의 결과로 온화한 조건에서 두 고리 시스템에 접근할 수 있다. 사이클로데카-3-엔-1,5-다이인은 37 °C에서 1,3-사이클로헥사다이엔과 반응하여 벤젠과 테트랄린을 생성하며, 두 개의 새로운 방향족 고리가 형성되어 보다 반응에 유리하게 된다.
같이 보기
[편집]각주
[편집]- ↑ 가 나 Smith, Michael B.; March, Jerry (2007), 《Advanced Organic Chemistry: Reactions, Mechanisms, and Structure》 6판, New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ↑ Gary, J.H.; Handwerk, G.E. (1984). 《Petroleum Refining Technology and Economics》 2판. Marcel Dekker, Inc. ISBN 0-8247-7150-8.
- ↑ Ono, Y. (1992). “Transformation of Lower Alkanes into Aromatic Hydrocarbons over ZSM-5 Zeolites.”. 《Catal. Rev. - Sci. Eng.》 34 (3): 179–226. doi:10.1080/01614949208020306.
- ↑ Lephart, E. D. (1996). “A review of brain aromatase cytochrome P450”. 《Brain Res. Rev.》 22 (1): 1–26. doi:10.1016/0165-0173(96)00002-1. PMID 8871783. S2CID 11987113.
- ↑ 가 나 Avendaño, C.; Menéndez, J. C. (2008). 〈Aromatase Inhibitors〉. 《Medicinal Chemistry of Anticancer Drugs》. Elsevier. 65–73쪽. doi:10.1016/B978-0-444-52824-7.00003-2. ISBN 9780080559629.
- ↑ Jasek, W., 편집. (2007). 《Austria-Codex》 (독일어) 62판. Vienna: Österreichischer Apothekerverlag. 656–660쪽. ISBN 9783852001814.
- ↑ Dinnendahl, V.; Fricke, U., 편집. (2007). 《Arzneistoff-Profile》 (독일어) 4 21판. Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 9783774198463.
- ↑ Brown, W.; Turner, A. B. (1971). “Applications of High-Potential Quinones. Part VII. The Synthesis of Steroidal Phenanthrenes by Double Methyl Migration”. 《Journal of the Chemical Society C: Organic》 14: 2566–2572. doi:10.1039/J39710002566. PMID 5167256.
- ↑ Bergmann, F.; Szmuszkowicz, J.; Fawaz, G. (1947). “The Condensation of 1,1-Diarylethylenes with Maleic Anhydride”. 《Journal of the American Chemical Society》 69 (7): 1773–1777. doi:10.1021/ja01199a055. PMID 20251415.
- ↑ Bennett, M. A.; Huang, T. N.; Matheson, T. W.; Smith, A. K. (1982). “(η6-Hexamethylbenzene)ruthenium Complexes”. 《Inorganic Syntheses》 21: 74–78. doi:10.1002/9780470132524.ch16. ISBN 9780470132524.
- ↑ Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. (2005). 〈Pyridine and Pyridine Derivatives〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. Wiley-VCH. doi:10.1002/14356007.a22_399. ISBN 3527306730.
- ↑ Horning, E. C.; Stromberg, V. L.; Lloyd, H. A. (1952). “Beckmann Rearrangements. An Investigation of Special Cases”. 《Journal of the American Chemical Society》 74 (20): 5153–5155. doi:10.1021/ja01140a048.
- ↑ Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. (2001). 《Organic Chemistry》 1판. Oxford University Press. 531쪽. ISBN 9780198503460.
- ↑ Capponi, M.; Gut, I. G.; Hellrung, B.; Persy, G.; Wirz, J. (1999). “Ketonization Equilibria of Phenol in Aqueous Solution”. 《Canadian Journal of Chemistry》 77 (5–6): 605–613. doi:10.1139/cjc-77-5-6-605.
- ↑ Kündig, E. P.; Garcia, A. E.; Lomberget, T.; Bernardinelli, G. (2005). “Rediscovery, Isolation, and Asymmetric Reduction of 1,2,3,4-Tetrahydronaphthalene-1,4-dione and Studies of its [Cr(CO)3] Complex”. 《Angewandte Chemie International Edition》 45 (1): 98–101. doi:10.1002/anie.200502588. PMID 16304647.
- ↑ Cotton, F. A.; Wilkinson, G. (1999). 《Advanced Inorganic Chemistry》 6판. John Wiley and Sons. ISBN 9780471199571.
- ↑ Mohamed, R. K.; Peterson, P. W.; Alabugin, I. V. (2013). “Concerted Reactions that Produce Diradicals and Zwitterions: Electronic, Steric, Conformational and Kinetic Control of Cycloaromatization Processes”. 《Chemical Reviews》 113 (9): 7089–7129. doi:10.1021/cr4000682. PMID 23600723.