테노포비르 알라페나미드
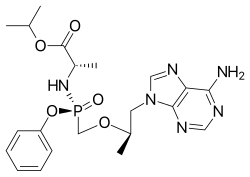
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
| Isopropyl (2S)-2-[[[(1R)-2-(6-aminopurin-9-yl)-1-methyl-ethoxy]methyl-phenoxy-phosphoryl]amino]propanoate | |
| 식별 정보 | |
| CAS 등록번호 | 379270-37-8 |
| ATC 코드 | J05AF13 Combination codes: J05AR17 J05AR18 J05AR19 |
| PubChem | 9574768 |
| 드러그뱅크 | DB09299 |
| ChemSpider | 7849225 |
| 화학적 성질 | |
| 화학식 | C21H29N6O5P |
| 분자량 | 476.466 g/mol |
| SMILES | eMolecules & PubChem |
| 유의어 | GS-7340 |
| 약동학 정보 | |
| 생체적합성 | ? |
| 단백질 결합 | ~80%[1] |
| 동등생물의약품 | ? |
| 약물 대사 | ? |
| 생물학적 반감기 | 0.51 hours |
| 배출 | Feces (31.7%), urine (<1%) |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | ? |
| 법적 상태 |
|
| 투여 방법 | Oral (tablets) |
젠보야(Genvoya)는 후천성면역결핍증 치료제로, 테노포비르 알라페나미드 푸마르산염(Tenofovir Alafenamide Fumarate), 엘비테그라비르(Elvitegravir), 엠트리시타빈(Emtricitabine), 코비시스타트 이산화규소(Cobicistat Silicon Dioxide) 성분으로 구성되어 있다. 각 성분에 대해 내성 관련 치환이 없는 성인과 만 12세 이상 청소년이 복용할 수 있으며 하루 1정을 음식과 함께 복용하면 된다.[2]
주요 성분인 테노포비르 알라페나미드(TAF)는 림프구 내로 흡수된 후에 그 효과가 발휘되는 표적 전구 약물(prodrug)로, 젠보야는 이를 통해 후천성면역결핍증의 원인 바이러스인 HIV에 대한 항바이러스 효과를 발휘한다.[3]
젠보야는 이보다 앞서 출시되었던 후천성면역결핍증 치료제인 스트리빌드(Stribild)와의 비교 임상 실험에서 비열등한 지속적인 바이러스 억제 효과를 입증했다. 임상은 치료 경험이 없는 HIV-1 감염 성인 환자를 대상으로 진행되었으며, 48주 시점에 젠보야 복용 환자군의 92%, 스트리빌드 복용 환자군의 90%에서 바이러스 억제 효과가 나타났다.[4]
국내에는 2017년 2월 급여 출시되어[5] 2017년 6월 현재 국립중앙의료원, 서울순천향대병원, 연세대학교세브란스병원, 삼성서울병원, 분당서울대병원, 충남대병원 등 약 50곳의 주요 병원에서 처방받을 수 있다.[6]
각주
[편집]- ↑ “GENVOYA (elvitegravir, cobicistat, emtricitabine, and tenofovir alafenamide) Tablets, for Oral Use. Full Prescribing Information” (PDF). Gilead Sciences, Inc. Foster City, CA 94404.
- ↑ [1], 약학정보원 의약품정보; 젠보야
- ↑ [2], 데일리메디, 200억 매출 스트리빌드 후속 젠보야 스위칭 '순항'
- ↑ [3], 메디파나뉴스, 길리어드의 자신감‥ TAF 기반 '데스코비'·'젠보야'
- ↑ [4], 메디파나뉴스, 최초 TAF포함 HIV 단일정 복합제 '젠보야' 출시
- ↑ [5], 의학신문, 젠보야 서울대‧NMC 등 50개 병원 입성
| 이 글은 의학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |