HLA-A
| ГКХ класа I, А | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| (хетеродимер) | ||||||||||
 Илустрација на HLA-A | ||||||||||
| Тип на протеин | Трансмембрански протеин | |||||||||
| Функција | Пептидна презентација за имуно препознавање | |||||||||
| ||||||||||
HLA-A — група на човечки леукоцитни антигени (HLA) кои се кодирани од HLA-A локусот, кој се наоѓа на човечкиот хромозом 6p21.3.[1] HLA е главен антиген на комплексот за хистокомпатибилност (MHC) специфичен за луѓето. HLA-A е еден од трите главни видови човечки трансмембрански протеини од класа I на човечки ГКХ. Другите се HLA-B и HLA-C.[2] Протеинот е хетеродимер и е составен од тежок α синџир и помал β синџир. α синџирот е кодиран од варијантен HLA-A ген, а β синџирот (β2микроглобулин) е непроменлива молекула на β2 микроглобулин.[3] Протеинот β2 микроглобулин е кодиран од генот B2M,[4] кој се наоѓа во хромозомот 15q21.1 кај луѓето.[5]
Молекулите на ГКХ класа I, како што е HLA-A, учествуваат во процес кој претставува кратки полипептиди на имунолошкиот систем. Овие полипептиди најчесто се типично 7-11 аминокиселини во должина и потекнуваат од протеините што ги изразува клетката. Постојат две класи на полипептиди кои можат да бидат претставени со HLA протеинот: оние кои се претпоставува дека се изразени од клетката и оние од странска деривација.[6] Во нормални услови, цитотоксичните Т-клетки, кои нормално патролираат во телото во крвта, го „читаат“ пептидот претставен од комплексот. Т-клетките, доколку функционираат правилно, се врзуваат само за не-само-пептидите. Доколку се појави врзување, се започнуваат низа настани кои кулминираат со клеточна смрт преку апоптоза.[7] На овој начин, човечкото тело ги елиминира сите клетки инфицирани со вирус или кои изразуваат протеини што не би требало да бидат (на пример канцерогени клетки).
За луѓето, како и кај повеќето популации на цицачи, молекулите на ГКХ класа I се екстремно променливи во нивната примарна структура, а HLA-A е рангирана помеѓу гените со најбрзо развивачка кодирана секвенца кај луѓето. Според податоци од март 2022 година, постојат 7.452 познати HLA-A алели кои кодираат за 4.305 активни протеини и 375 нулти протеини. Ова ниво на варијација на ГКХ класа I е примарна причина за отфрлање на трансплантацијата, бидејќи случајната трансплантација помеѓу донаторот и домаќинот веројатно нема да резултира со совпаѓање на HLA-A, B или C антигени. Еволутивните биолози, исто така, веруваат дека широката варијација на HLA е резултат на балансирачки чин помеѓу судирните патогени притисоци. Поголемата разновидност на HLA ја намалува веројатноста и целата популација ќе биде избришана од еден патоген бидејќи одредени индивидуи ќе бидат високо отпорни на секој патоген. Ефектот на варијацијата HLA-A врз прогресијата на ХИВ/СИДА е дискутиран подолу.
HLA-A ген
[уреди | уреди извор]HLA-A генот се наоѓа на краткиот крак на хромозомот 6 и го шифрира поголемиот, α-синџир, составен дел на HLA-A. Варијацијата на HLA-A α-синџир е клучна за HLA функцијата. Оваа варијација промовира генетска разновидност кај популацијата. Бидејќи секој HLA има различен афинитет за пептиди од одредени структури, поголема разновидност на HLA значи дека поголема разновидност на антигени може да се „претстават“ на клеточната површина, што ја зголемува веројатноста дека подгрупата од популацијата ќе биде отпорна на даден надворешен напаѓач. Ова ја намалува веројатноста дека еден патоген има способност да ја избрише целата човечка популација.
Секој поединец може да изрази до два типа на HLA-A, по еден од секој од нивните родители. Некои поединци ќе го наследат истиот HLA-A од двата родители, намалувајќи ја нивната поединечна HLA разновидност; сепак, мнозинството поединци ќе добијат две различни копии на HLA-A . Истата шема следи за сите HLA групи.[12] Со други зборови, секој човек може да изрази само еден или два од 2432 познати HLA-A алели.
Алели
[уреди | уреди извор]На сите HLA им е доделено име од Комитетот за именување на Светската здравствена организација за фактори на системот HLA. Ова име е организирано за да обезбеди најмногу информации за конкретниот алел, додека името е што е можно пократко. Името на HLA изгледа вака:
HLA-A*02:01:01:02L
Сите алели добиваат најмалку четирицифрена класификација (HLA-A*02:12). А означува на кој HLA ген му припаѓа алелот. Има многу HLA-A алели, така што класификацијата по серотип ја поедноставува категоризацијата. Следниот пар цифри ја означува оваа задача. На пример, HLA-A*02:02 Архивирано на 16 декември 2013 г., HLA-A*02:04 Архивирано на 16 декември 2013 г., and HLA-A*02:324 Архивирано на 16 декември 2013 г. сите се членови на серотипот А2 (означен со префиксот *02).[2] Оваа група е примарен фактор одговорен за HLA компатибилноста. Сите броеви по ова не можат да се одредат со серотипизација и се назначени преку секвенционирање на гените. Вториот сет на цифри покажува каков HLA протеин се произведува. Овие се доделени по редослед на откривање и од декември 2013 година се познати 456 различни HLA-A*02 протеини (доделени имиња HLA-A*02:01 до HLA-A*02:456). Најкраткото можно име на HLA ги вклучува двата од овие детали. Секоја екстензија надвор од тоа означува синонимни мутации во областа на кодирање и мутации надвор од регионот за кодирање. Толкувањето на наставките е опфатено подетално во денешниот систем за именување HLA.
Протеини
[уреди | уреди извор]Протеинот кодиран од генот HLA-A е долг 365 аминокиселини и тежи приближно 41.000 далтони (Da).[13] It contains 8 exons.[14] Содржи 8 егзони.
| Егзон | Протеински сегмент |
|---|---|
| 1 | Сигнален пептид |
| 2 | α1 |
| 3 | α2 |
| 4 | α3 |
| 5 | трансмембрански регион |
| 6 | цитоплазматска опашка |
| 7 | цитоплазматска опашка |
| 8 | неодредено |
HLA-A сигналниот пептид е серија на хидрофобни аминокиселини присутни на N-терминус на протеинот што го насочува кон ендоплазматскиот ретикулум каде што се преведени преостанатите седум домени.[13][14][15] Трите α домени го формираат сврзувачкиот жлеб кој држи пептид за презентација на CD8+ t-клетките. Трансмембранскиот регион е регионот кој е вграден во фосфолипидниот двослој што го опкружува луменот на ЕР.[14] Протеинот HLA-A е трансмембрански протеин со еден премин. Со други зборови, првите четири домени на протеинот се во луменот на ЕР, додека последните три домени се присутни надвор од луменот, што му дава на протеинот потребната ориентација за правилна функција. Последните три домени на протеинот формираат опашка од првенствено β-плочки кои остануваат во цитозолот на клетката.
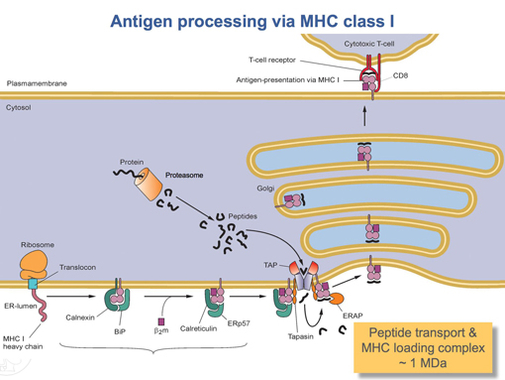
Откако HLA-A протеинот е целосно преведен, мора да се свитка во правилна форма. Молекуларниот шаперонски протеин наречен калнексин и ензимот наречен ERp57 помагаат во процесот на превиткување. Калнексинот го држи тешкиот ланец HLA-A додека Erp57 ги катализира дисулфидните врски помеѓу тешкиот ланец и лесниот, β2 - микроглобулин синџир. Оваа врска предизвикува конформациска промена во тешкиот синџир, формирајќи го жлебот за врзување. Калнексин потоа се дисоцира со комплексот, кој веќе се нарекува комплекс за оптоварување на пептиди, и се заменува со калретикулин, друг протеин на шаперон. Кратките пептиди постојано се транспортираат од околу клетката во луменот на ЕР преку специјализиран транспортен протеин наречен ТАП. Тој потоа се врзува за комплексот за оптоварување на пептиди заедно со друг протеин, наречен тапазин. Во овој момент, комплексот за оптоварување на пептиди се состои од HLA-A (тежок ланец), β2 - микроглобулин (лесен синџир), ензим ERp57, протеин калретикулин шаперон, ТАП (со врзан пептиден фрагмент) и тапазин. Тапасин ја зголемува стабилноста на ТАП, покрај тоа што го стабилизира целиот комплекс за оптоварување на пептиди. Во овој момент ТАП го ослободува пептидот што го транспортира во луменот на ЕР. Близината на HLA-A врзувачкиот жлеб до TAP е обезбедена со комплексот за оптоварување на пептиди. Ова ја зголемува веројатноста дека пептидот ќе го најде жлебот. Доколку афинитетот на пептидот за протеинот HLA-A е доволно голем, тој се врзува во жлебот.[17] Истражувањата сугерираат дека тапасинот може активно да ги вчита пептидите од ТАП во комплексот HLA-A, додека исто така држи молекули од класа I во луменот на ЕР додека не се врзе пептид со висок афинитет.[18]
Откако пептидот со доволно висок афинитет ќе се поврзе со класа I MHC, калретикулин, ERp57, TAP и тапасин ја ослободуваат молекулата.[17] Во овој момент, комплексот од класа I се состои од протеин HLA-A поврзан со β2 - микроглобулин и краток пептид. Сè уште е закотвен во ER мембраната од трансмембранскиот домен. Во одреден момент ЕР ќе добие сигнал и делот од мембраната што го држи комплексот ќе пукне и ќе биде транспортиран до телата на голгите за понатамошна обработка. Од голгиските тела, комплексот се транспортира, повторно преку транспорт на везикули, до клеточната мембрана. Ова е точката во која ориентацијата спомената претходно станува важна. Делот од HLA-A комплексот што го држи пептидот мора да биде на надворешната површина на клеточната мембрана. Ова се постигнува со фузија на везикулите со клеточната мембрана.[15]
Функција
[уреди | уреди извор]Природна функција
[уреди | уреди извор]Молекулите на MHC класа I претставуваат мали пептиди, типично од 7-10 аминокиселини во должина, на имунолошкиот систем. Гликопротеинот наречен CD8 се врзува за остатоците 223-229 во α3 доменот на HLA-A и овој гликопротеин ги стабилизира интеракциите помеѓу т-клеточниот рецептор на цитотоксичните (CD8 + ) Т-лимфоцити и MHC од класа I.[19] Т-клеточниот рецептор, исто така, има потенцијал да се поврзе со пептидот претставен од MHC. Во правилно функционирање на имунолошкиот систем, единствено Т-клетки кои не се врзуваат за самите пептиди се дозволени надвор од тимусот, така што, доколку Т-клетка се поврзе за пептидот, тоа мора да биде туѓ или абнормален пептид. Т-клетката потоа иницира апоптоза, или програмирана клеточна смрт. Овој процес може да се случи дури 5 минути по првичната презентација на странски антиген, иако обично се потребни неколку часа за да стане очигледна смртта.[20] Овој процес е основа на стекнатиот имунитет и служи како примарна одбрана од вируси и други интрацелуларни патогени.
Други активности
[уреди | уреди извор]До 1960-тите, станало очигледно дека факторите на донираните органи и ткива често резултирале со уништување на донираното ткиво од имунолошкиот систем на домаќинот. MHC првично биле откриени како резултат на ова набљудување. Постојат два типа на комплекси кои презентираат пептиди, MHC од класа I и класа II. Секој од нив има повеќе HLA гени, од кои HLA-A е само еден. Постојат три главни HLA кои треба да се усогласат помеѓу донаторите и примателите. Тие се HLA-A, HLA-B, (и двете од класа I MHC) и HLA-DR (MHC од класа II). Ако двете ткива имаат исти алели кои ги кодираат овие три HLA, веројатноста и сериозноста на отфрлање се минимизираат.[21]
Улога во болеста
[уреди | уреди извор]| Поврзана болест | Серотипови | ||
| Анкилозен спондилитис | A24 | ||
| Дијабетес, тип-I[22] | A1 | A24 | |
| Хемохроматоза (пониски ЦД8+ клетки) | A3 | ||
| Мијастенија гравис | A3 | A24 | A30 |
| Леукемија, Т-клетки, Возрасни | A26 | A68 | |
| Мултиплекс склероза | A3 | ||
| Папилома | A11 | ||
| Спонтан абортус | A2 | ||
HLA служат како единствена врска помеѓу имунолошкиот систем и она што се случува внатре во клетките. Така, секоја промена од страна на HLA, било да е тоа намалено врзување за одреден пептид или зголемено врзување за одреден пептид, се изразува како, соодветно, зголемена подложност на болест или намалена подложност на болест. Со други зборови, одредени HLA може да не се способни да врзат кој било од кратките пептиди произведени со протеолиза на патогени протеини. Доколку е така, нема начин имунолошкиот систем да покаже дека клетката е заразена. Така, инфекцијата може да се пролиферира во голема мера неконтролирано. Тоа работи и на друг начин. Некои HLA врзуваат патогени пептидни фрагменти со многу висок афинитет. Ова во суштина го „надополнува“ нивниот имунолошки систем во однос на тој конкретен патоген, овозможувајќи им да управуваат со инфекција која инаку би можела да биде катастрофална.[6]
ХИВ/СИДА
[уреди | уреди извор]Еден од најистражуваните примери за диференцијална имунолошка регулација на патогенот е оној на вирусот на хумана имунодефициенција Бидејќи ХИВ е РНК вирус, тој мутира неверојатно брзо. Ова ги менува пептидите произведени преку протеолиза, што ги менува пептидите способни да му се претстават на имунолошкиот систем од MHC на заразената клетка. Секој вирус со мутација што создава пептид со висок афинитет за одреден HLA брзо се убива од имунолошкиот систем и на тој начин не преживува и тој пептид со висок афинитет повеќе не се произведува. Сепак, излегува дека дури и ХИВ има некои конзервирани региони во својот геном, и ако HLA е способен да се врзе за пептид произведен од конзервирана област, ХИВ може малку да направи за да избегне имуно откривање и уништување. Ова е принципот зад диференцијалните оптоварувања на ХИВ посредувани од HLA.
Со преку 2000 варијации на HLA-A кодираниот MHC, тешко е да се одреди влијанието на сите варијанти врз оптоварувањето со ХИВ. Сепак, неколку избрани се вмешани. Се покажало дека HLA-A*30 го намалува вирусното оптоварување на помалку од 10.000 копии/кубен милиметар, што се смета за доста ниско. Од друга страна, HLA-A*02 е вмешан во високото вирусно оптоварување (поголемо од 100.000 копии/кубен милиметар) кога е поврзано со HLA-B*45. Дополнително, хаплотиповите HLA-A*23-C*07 и HLA-A*02-C*16 вообичаено изразуваат зголемени вирусни оптоварувања во популацијата на примерокот на Замбијците. Еден од најефикасните хаплотипови кои го инхибираат ХИВ бил HLA-A*30-C*03 додека еден од најмалку ефикасните бил HLA-A*23*B*14. Накратко, HLA-A*23 бил во голема корелација со зголеменото оптоварување на ХИВ кај популацијата на примерокот, иако е важно да се забележи дека кај примероците од различна етничка припадност оваа корелација значително се намалува.[23]
Иако класификацијата на ефектот на поединечните HLA гени и алели врз присуството на ХИВ е тешка, сепак постојат некои силни заклучоци што може да се направат. Поединците кои се хомозиготни во еден или повеќе HLA гени од класа I обично напредуваат до СИДА многу побрзо отколку хетерозиготите. Кај некои хомозиготни индивидуи стапката на прогресија е двојно поголема од онаа на хетерозиготите. Оваа диференцијална прогресија е прилично тесно поврзана со степенот на хетерозиготност.[24] Накратко, одредени HLA-A алели се поврзани со различни вирусни оптоварувања кај пациенти инфицирани со ХИВ; сепак, поради различноста меѓу тие алели, тешко е да се класифицира влијанието на секој алел врз имунолошката регулација на ХИВ. Сепак, можно е да се поврзе хетерозиготноста кај HLA-A алелите со намалената стапка на прогресија кон СИДА.
Не само што одредени HLA алели пропишуваат зголемена или намалена отпорност на ХИВ, туку ХИВ може да ја промени експресијата на HLA и тоа селективно доведува до намалена елиминација од природните клетки убијци (NK-клетки). Истражувањата покажале дека ХИВ ја намалува експресијата на MHC од класа I во инфицираните клетки. Меѓутоа, со тоа неселективно се отвора можност за напад од NK-клетките, бидејќи NK-клетките реагираат на надолна регулација на HLA-C и HLA-E. Очигледно, овој механизам изврши селективен притисок врз ХИВ вирусот. Така, ХИВ ја развива способноста да ги намалува HLA-A и HLA-B без значително да го наруши изразувањето на HLA-C и HLA-E.[25] Протеинот кодиран од геномот на ХИВ, негативниот регулаторен фактор (Nef), ја индуцира оваа промена со врзување за цитоплазматската опашка на MHC од класа I додека е сè уште во ендоплазматскиот ретикулум или повремено додека е во раните фази на трговијата преку телата на голгите. Овој комплекс на MHC и Nef потоа предизвикува адаптерскиот протеин 1 (AP-1) да го насочи MHC кон лизозомите за разградување наместо кон клеточната мембрана каде што нормално функционира.[26] Покрај селективното намалување на HLA, негативниот регулаторен фактор (Nef) му овозможува на ХИВ да ги намали ЦД4 и ЦД8. Овие гликопротеини се од суштинско значење за, соодветно, помошни т-клетки и цитотоксични t-клетки врзување за MHCs. Без овие кофактори, и двата типа т-клетки се со помала веројатност да се врзат за HLA и да иницираат апоптоза, дури и ако HLA изразува пептид добиен од ХИВ (не-само-само). И двата од овие протеини се исто така насочени кон нивниот домен на цитоплазматската опашка. Комбинацијата на овие способности во голема мера ја подобрува способноста на ХИВ да избегне откривање од страна на имунолошкиот систем.
Резиме
[уреди | уреди извор]HLA-A е една посебна група на човечки MHC од класа I. Се состои од неколку стотици различни гени и неколку илјади варијантни алели. HLA-A е критичен за имунолошкиот одговор контролиран од цитотоксичните т-клетки на вируси и други интрацелуларни патогени. Бидејќи секој HLA-A ген има висок афинитет за малку различни пептиди, одредени HLA-A се поврзани со зголемен ризик, побрза прогресија и/или зголемена сериозност на многу болести. Од слични причини, HLA-A совпаѓањето е од суштинско значење за успешна трансплантација на ткиво.
Наводи
[уреди | уреди извор]- ↑ „HLA Nomenclature @ hla.alleles.org“. Anthony Nolan Research Institute. 10 Nov 2013. Посетено на 8 Dec 2013.
- ↑ 2,0 2,1 „Statistics“. European Bioinformatics Institute (EBI) / European Molecular Biology Laboratory (EMBL). Архивирано од изворникот на 10 September 2017. Посетено на 13 Dec 2013.
- ↑ Delves PJ (Aug 2013). „Human Leukocyte Antigen (HLA) System: Biology of the Immune System“. Merck Manual Professional. Merck Sharp & Dohme Corp. Посетено на 14 Dec 2013.
- ↑ „B2M Gene“. GeneCards. Weizmann Institute of Science. 7 Nov 2013. Посетено на 14 Dec 2013.
- ↑ „OMIM Entry - * 109700 - BETA-2-MICROGLOBULIN;B2M“. Online Mendelian Inheritance in Man. Johns Hopkins University. 5 Aug 2016. Посетено на 14 May 2021.
- ↑ 6,0 6,1 Daniel M. Davis (2014). The Compatibility Gene. How Our Bodies Fight Disease, Attract Others, and Define Our Selves. Oxford: Oxford University Press. ISBN 978-0-19-931641-0.
- ↑ Accorsi D (14 Sep 2012). „MHC class I assembly and presentation“. YouTube. Посетено на 8 Dec 2013.
- ↑ 8,0 8,1 8,2 ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 GRCh38: Ensembl release 89: ENSG00000206505, ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 - Ensembl, May 2017
- ↑ 9,0 9,1 9,2 GRCm38: Ensembl release 89: ENSMUSG00000091705 - Ensembl, May 2017
- ↑ „Навод во Human PubMed:“. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ „Навод во Mouse PubMed:“. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Fix M (1998). „HLA Matching, Antibodies, and You“. Kidney Transplantation: Past, Present, and Future. University of Michigan Medical Center/Stanford University. Архивирано од изворникот на 2014-03-09. Посетено на 14 Dec 2013.
- ↑ 13,0 13,1 „Major Histocompatibility Complex, Class I, A“. Gene Cards. Weizmann Institute of Science. 7 November 2013. Посетено на 16 December 2013.
- ↑ 14,0 14,1 14,2 „HLA-A major histocompatibility complex, class I, A [Homo sapiens (human)]“. National Center for Biotechnology Information. U.S. National Library of Medicine. 12 December 2013. Посетено на 16 December 2013.
- ↑ 15,0 15,1 Alberts, Bruce (2010). Essential Cell Biology (Third. изд.). Garland Science. ISBN 9780815341291.
- ↑ Tampé, Robert. „P16 Translocation mechanism and viral inhibition of the MHC I peptide-loading complex“. Molecular Understanding of Transmembrane Processes. Institute of Biochemistry Biocenter. Посетено на 16 December 2013.
- ↑ 17,0 17,1 Accorsi, Diego (14 September 2012). „MHC class I assembly and presentation“. Immunology Toronto. Department of Immunology and Biochemistry and Biomedical Communications at the University of Toronto. Посетено на 16 December 2013.
- ↑ Grandea AG, Van Kaer L (April 2001). „Tapasin: an ER chaperone that controls MHC class I assembly with peptide“. Trends in Immunology. 22 (4): 194–9. doi:10.1016/S1471-4906(01)01861-0. PMID 11274924.
- ↑ „CD8“. T-cell Modulation Group. tcells.org. 2009. Архивирано од изворникот на 18 February 2013. Посетено на 17 December 2013.
- ↑ Janeway, Charles A. (2001). „8“. Immunobiology the immune system health & disease (5.. изд.). New York: Garland. ISBN 978-0815336426. Посетено на 17 December 2013.
- ↑ Solomon S, Pitossi F, Rao MS (February 2015). „Banking on iPSC--is it doable and is it worthwhile“. Stem Cell Reviews. 11 (1): 1–10. doi:10.1007/s12015-014-9574-4. PMC 4333229. PMID 25516409.
- ↑ Noble JA, Valdes AM, Bugawan TL, Apple RJ, Thomson G, Erlich HA (August 2002). „The HLA class I A locus affects susceptibility to type 1 diabetes“. Human Immunology. 63 (8): 657–64. doi:10.1016/S0198-8859(02)00421-4. PMC 4049513. PMID 12121673.
- ↑ Tang J, Tang S, Lobashevsky E, Myracle AD, Fideli U, Aldrovandi G, Allen S, Musonda R, Kaslow RA (August 2002). „Favorable and unfavorable HLA class I alleles and haplotypes in Zambians predominantly infected with clade C human immunodeficiency virus type 1“. Journal of Virology. 76 (16): 8276–84. doi:10.1128/JVI.76.16.8276-8284.2002. PMC 155130. PMID 12134033.
- ↑ Carrington M, Nelson GW, Martin MP, Kissner T, Vlahov D, Goedert JJ, Kaslow R, Buchbinder S, Hoots K, O'Brien SJ (March 1999). „HLA and HIV-1: heterozygote advantage and B*35-Cw*04 disadvantage“. Science. 283 (5408): 1748–52. Bibcode:1999Sci...283.1748C. doi:10.1126/science.283.5408.1748. PMID 10073943.
- ↑ Cohen GB, Gandhi RT, Davis DM, Mandelboim O, Chen BK, Strominger JL, Baltimore D (June 1999). „The selective downregulation of class I major histocompatibility complex proteins by HIV-1 protects HIV-infected cells from NK cells“. Immunity. 10 (6): 661–71. doi:10.1016/S1074-7613(00)80065-5. PMID 10403641.
- ↑ Leonard JA, Filzen T, Carter CC, Schaefer M, Collins KL (July 2011). „HIV-1 Nef disrupts intracellular trafficking of major histocompatibility complex class I, CD4, CD8, and CD28 by distinct pathways that share common elements“. Journal of Virology. 85 (14): 6867–81. doi:10.1128/JVI.00229-11. PMC 3126561. PMID 21543478.




